【学术宝库】高军主任解读: 接受辅助生殖治疗的PCOS患者流产胚胎染色体畸变率较高
背景
多囊卵巢综合征 (polycystic ovary syndrome,PCOS) 是育龄期妇女常见的内分泌疾病,影响了6%-25% 的育龄期女性,其发病率具体取决于各中心采取的具体诊断标准 [1]。PCOS 表现为稀发排卵/无排卵、雄激素过多和多囊卵巢 [2]。通常认为PCOS 患者内分泌异常,可能会影响卵母细胞内环境,破坏颗粒细胞和卵母细胞之间的交通,对卵母细胞减数分裂和受精会产生重要的影响 [3,4]。PCOS 女性需要辅助生殖技术 (ART)助孕的概率是非 PCOS 女性的 8 至 10 倍 [5,6]。尽管越来越多的证据表明,PCOS 患者在控制性卵巢刺激后产生更多的卵母细胞,但 PCOS 患者的妊娠结局远不能令人满意。在 PCOS 患者中可观察到的较低的受精率和较高的早期自然妊娠丢失风险 [7-9],表明了卵母细胞和胚胎质量可能较差 [10-12]。与对照组相比,PCOS 妇女的 2-细胞期胚胎中多核染色体的增加被认为是胚胎染色体异常的原因[13]。
约有15%-20% 的临床妊娠发生孕早期流产,50% 可归因于胚胎染色体异常 [14]。然而,染色体畸变在 PCOS 人群孕早期自然流产中所起的作用仍无定论。
本期的生殖专家文献解读邀请中山大学附属第一医院生殖医学中心副主任医师高军解读《Higher chromosomal aberration rate in miscarried conceptus from polycystic ovary syndrome women undergoing assisted reproductive treatment》,该篇文献由Ying Li, Yingpu Sun(通讯作者)等发表在2019年5月的Fertility and Sterility中。
文献摘要
研究问题:
评估辅助生殖技术(ART)治疗期间多囊卵巢综合征(PCOS)与流产组织中胚胎染色体异常之间的潜在相关性。
研究设计:
单中心、回顾性研究。研究对象为2013年1月至2016年9月期间郑州大学附属第一医院生殖中心328例接受ART治疗的孕早期流产患者,对其流产组织进行基因检查,其中119例为PCOS组,209例为非PCOS对照组。在任何研究对象中均不存在已知的流产相关因素。对所有收集的样品进行SNP单核苷酸多态性阵列分析。主要观察指标为流产胚胎核型异常的发生率及PCOS与染色体异常流产的相关性。
入排标准:
Ø 排除高龄(>35岁)、染色体核型异常、有复发性流产病史(两次或两次以上流产)、甲状腺功能障碍、子宫异常(如子宫内膜异位,子宫腺肌症或粘膜下肌瘤)、多胎妊娠或供体卵母细胞周期、排除40岁以上男性伴侣的患者
Ø PCOS诊断采用2003年鹿特丹共识;对照组不孕因素包括男性因素不孕,不明原因不孕,输卵管因素不孕和卵巢储备降低等。
方案:
Ø 在本研究中,将受试者分为三类,37名接受IUI治疗,211名接受IVF治疗,80名ICSI治疗。
Ø IUI促排药物:来曲唑或HMG,IUI时机:优势卵泡的直径等于或大于16mm
Ø IVF/ICSI组进行常规促排。 扳机时机及药物:至少两个优势卵泡的直径达到20 mm时,注射5000–10000 U hCG, 36–38小时后取卵。
Ø 对流产组织进行SNP阵列分析和数据分析,以找到染色体的拷贝数变异(CNVs)。再进行逻辑回归分析找出导致染色体畸变的相关危险因素。
结果
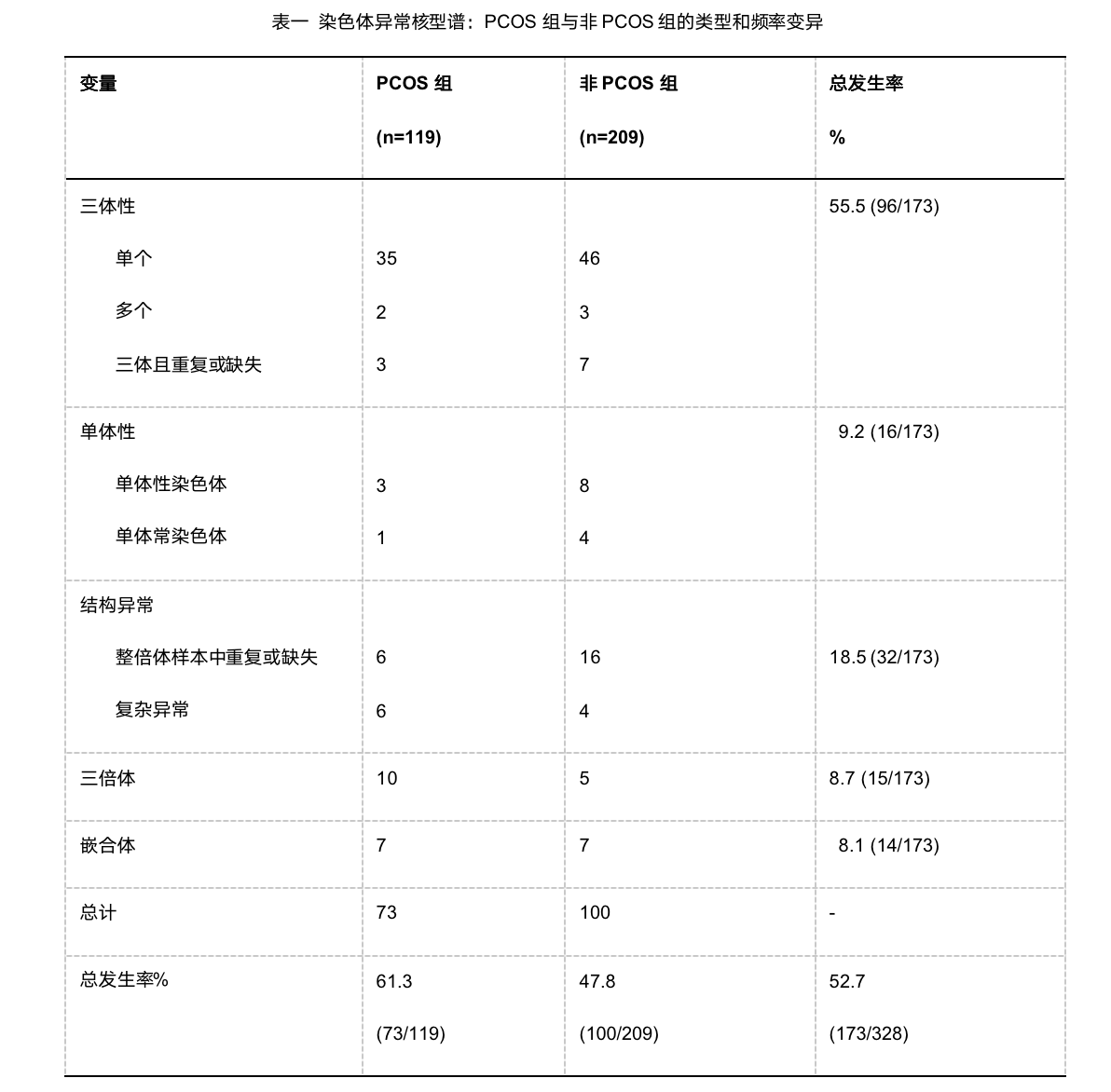
Ø 对328份流产组织成功进行了流产组织的SNP分析。52.7%(173/328)的流产组织存在染色体异常。
Ø 与对照组相比,PCOS 患者的胎体染色体异常更常见 (61.3% vs. 47.8%)。此外,单因素和多因素分析均可确定PCOS 是胚胎染色体异常的独立危险因素,比值比分别为 1.957(95% 置信区间,1.067-3.590)和 2.008(95% 置信区间,1.038-3.883)。
Ø 男性和女性胚胎之间的染色体异常分布相似(分别为50.3%和49.7%),表明两种性别的胎儿的等效分布,排除了母体污染的任何可能性(假阴性)。在大约91.3%的具有染色体异常的流产组织中,遗传畸变被预测为流产的原因。
 结论
结论
与非PCOS对照组相比,PCOS患者在ART期间胚胎染色体异常的风险增加。其机制需要进一步研究。植入前基因筛查可能是降低PCOS患者自然流产风险的有效方法。
关键词:多囊卵巢综合征(PCOS);单核苷酸多态性(SNP)阵列;孕早期流产;染色体核型
高军主任解读
本文探讨了PCOS患者助孕治疗后自然流产与染色体非整倍体之间的关系,研究结果提示PCOS患者流产胚胎染色体异常的比例显著高于非PCOS患者,PCOS是染色体异常流产的独立危险因素。这个研究部分地解释了PCOS患者流产率高于非PCOS患者的原因,给我们带来一些思考。
一.IVF后早期流产原因分析
在自然妊娠周期中,孕早期自然流产发生率约15%-20%,其中染色体异常发生率约50%。本文中检测到的流产组织染色体异常占比52%,与自然妊娠后自然流产胚胎染色体异常发生率相当。然而本文选取的研究对象为排除高龄(女方>35岁,男方>40岁)、复发性流产病史及甲状腺功能障碍、子宫异常患者,而自然周期妊娠中这些因素并没有排除,因此本研究中助孕周期孕早期自然流产率可能高于自然周期。究其原因考虑以下几点。
1.高水平的Gn影响: 在小鼠的实验中发现高剂量FSH影响卵母细胞减数分裂时微管和纺锤体的完整性,导致卵母细胞整倍体率下降[15,16]。在促排卵患者卵泡液中高水平的FSH与卵母细胞非整倍体率相关[17]。2018年一篇回顾性分析,比较了低剂量组和高剂量组整倍体胚胎率,发现无论在年轻还是年长患者,低剂量组有更高的整倍体率[18]。
2.不孕症群体有卵巢功能减退或生殖障碍,此类人群产生配子的异常率增高。
二、PCOS患者流产率增高原因
PCOS与流产中较高染色体异常有关的确切机制仍然不明。
1.流产与代谢、内分泌紊乱的关系
PCOS是一种常见的内分泌及代谢异常所致疾病。研究表明,高胰岛素血症及胰岛素抵抗可能是PCOS患者早期胚胎流产的危险因素[19-21]。国内有学者报道HOMA指数(用于评价个体胰岛素抵抗水平的指标)是PCOS患者流产的高危因素之一[22]。已有文献报道妊娠期使用二甲双胍有利于改善PCOS患者的胰岛素抵抗,减少流产率[20,21],胰岛素增敏剂的有利作用也从另一方面支持胰岛素抵抗是PCOS患者流产的高危因素。 但胰岛素抵抗是否是染色体异常发生率增高的原因尚无相关研究。
2.流产与肥胖的关系:
研究表明肥胖是流产发生的独立危险因素。 肥胖患者流产组织正常核型的概率较非肥胖患者高[23]。研究表明整倍体胚胎数目随着BMI的增高逐渐减少[24]。在动物实验中发现,肥胖小鼠卵母细胞的生殖泡裂解及第一极体排出受阻,卵母细胞恢复减数分裂的能力降低[25]。本文中PCOS组BMI>25的患者占比40.3%,显著高于对照组14.4%。
3.流产与高LH水平及高雄激素水平的关系
研究表明高水平LH可能抑制颗粒细胞中芳香化酶的活性和细胞生长,导致卵泡闭锁和过早黄素化[26];通过影响卵母细胞成熟和精卵结合,导致流产率增高[27,28]。高雄激素水平通过影响卵巢微环境直接影响卵泡发育,导致卵泡闭锁和黄体功能不全;影响PCOS患者的精卵结合与胚胎发育使妊娠丢失率升高[29]。然而高LH水平和高雄与胚胎染色体异常的关系尚未见相关报道。
三.重视PCOS患者进入周期前的生活方式调整
2018年ESHRE颁布PCOS诊治指南,PCOS患者一线治疗是生活方式调整,代谢性疾病的防治。包括血糖,体重,血压,吸烟,酒精摄入,睡眠,精神,情感和性健康教育[30]。本文的研究结果显示,PCOS患者高水平的胚胎染色体异常率是助孕治疗的不利影响因素。在PCOS患者进入周期前进行代谢性疾病的筛查,生活方式的调整,必要的减重及控制饮食,作息,心理精神因素的调整对于提高助孕治疗成功率,降低流产率均是非常必要的。要做到这一点不仅生殖科的医生要重视,对患者也需要进行宣教,从而实现高效,安全的助孕治疗。
参考文献
本文 Ying Li, et al. Fertility and Sterility. 2019 Mar 31;111(5):936-943.e2.
1. Dumesic DA, Oberfield SE, Stener-Victorin E, Marshall JC, Laven JS, Legro RS. Scientific statement on the diagnostic criteria, epidemiology, pathophysiology, and molecular genetics of polycystic ovary syndrome. Endocr Rev. 2015; 36:487–525.
2. Legro RS. Ovulation induction in polycystic ovary syndrome: current options. Best Pract Res Clin Obstet Gynaecol.2016;37:152–9.
3. Wood JR, Dumesic DA, Abbott DH, Strauss JF 3rd. Molecular abnormalities in oocytes from women with polycystic ovary syndrome revealed by microarray analysis. J Clin Endocrinol Metab.2007;92:705–13.
4. Palomba S, Falbo A, Zullo F, Orio F Jr. Evidence-based and potential benefits of metformin in the polycystic ovary syndrome: a comprehensive review. Endocr Rev. 2009; 30:1–50.
5. Broekmans FJ, Knauff EA, Valkenburg O, Laven JS, Eijkemans MJ, Fauser BC. PCOS according to the Rotterdam consensus criteria: change in prevalence among WHO-II anovulation and association with metabolic factors. BR J Obstet Gynecol. 2006; 113:1210–7.
6. Hart R, Doherty DA. The potential implications of a PCOS diagnosis on a woman's long-term health using data linkage. J Clin Endocrinol Metab
.2015;100:911–9.
7. Grundy SM. Hypertriglyceridemia, atherogenic dyslipidemia, and the metabolic syndrome. Am J Cardiol.1998;81:18B–25B.
8. Grundy SM. Hypertriglyceridemia, insulin resistance, and the metabolic syndrome. Am J Cardiol.1999;83:25F9F.
9. Grundy SM. Obesity, metabolic syndrome, and coronary atherosclerosis. Circulation 2002; 105:2696–8.
10. Kollmann M, Martins WP, Lima ML, Craciunas L, Nastri CO, Richardson A, et al. Strategies for improving outcome of assisted reproduction in women with polycystic ovary syndrome: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2016;48:709–18.
11. Qiao J, Feng HL. Extra- and intra-ovarian factors in polycystic ovary syndrome: impact on oocyte maturation and embryo developmental competence. Hum Reprod Update. 2011;17:17–33.
12. Weghofer A, Munne S, Chen S, Barad D, Gleicher N. Lack of association between polycystic ovary syndrome and embryonic aneuploidy. Fertil Steril 2007; 88:900–5.
13. Sundvall L, Kirkegaard K, Ingerslev HJ, Knudsen UB. Unaltered timing of embryo development in women with polycystic ovarian syndrome (PCOS): a time-lapse study. J Assist Reprod Gen. 2015; 32:1031–42.
14. Practice Committee of the American Society for Reproductive Medicine. Evaluation and treatment of recurrent pregnancy loss: a committee opinion. Fertil Steril. 2012; 98:1103–11.
15. Roberts R, Iatropoulou A, Ciantar D, et al. Follicle-stimulating hormone affects metaphase I chromosome alignment and increases aneuploidy in mouse oocytes matured in vitro. Biol Reprod,2005,72(1):107-18.
16. Rossi G(1), Macchiarelli G, Palmerini MG, et al. Meiotic spindle configuration is differentially influenced by FSH and epidermal growth factor during in vitro maturation of mouse oocytes. Hum Reprod. 2006,21(7):1765-70.
17. Hammoud I, Vialard F, Bergere M, et al. Follicular fluid protein content (FSH, LH, PG4, E2 and AMH) and polar body aneuploidy. J Assist Reprod Genet . 2012,29(10):1123-34.
18. Sachdeva K, Upadhyay D, Discutido R, et al. Genet Test Mol Biomarkers.2018,22(10):630-4.
19. Ke RW. Endocrine basis for recurrent pregnancy loss. Obstet Gynecol Clin North America,2014,41(1):103-112.
20. Palomba S, Falbo A, Jr OF, et al. Metformin hydrochloride and recurrent miscarriage in a woman with polycystic ovary syndrome. Fertil Steril,2006,85(5): 1511.e3
21. Morinpapunen L, Rantala AS, Unkilakallio L, et al. Metformin improves pregnancy and live-birth rates in women with polycystic ovary syndrome(PCOS):a multicenter, double-blind, placebo-controlled randomized trial. J Clin Endocrinol Metab,2012,97(5):1492-1500.
22. 李小兰,黄睿,方丛等. 多囊卵巢综合征患者体外受精/卵胞质内单精子注射-胚胎移植后自然流产相关高危因素的多元回归分析. 中华生殖与避孕杂志,2017,37(12):963-968.
23. Boots CE, Bernardi LA, Stephenson MD. Frequency of euploid miscarriage is increased in obese women with recurrent early pregnancy loss. Fertil Steril,2014,102:455-459.
24. Goldman KN, Hodes-Wertz B, McCulloh DH, et al. Association of body mass index with embryonic aneuploidy. Fertil Steril. 2015,103(3):744-8.
25. Luzzo KM, Wang Q, Purcell SH, et al. High fat diet induced developmental defects in the mouse: oocyte meiotic aneuploidy and fetal growth retardation/brain defects. PLoS One. 2012;7(11): e49217.
26. Hillier SG. Current concepts of the roles of follicle stimulating hormone and luteinizing hormone in folliculogenesis. Hum Reprod,1994,9:188-191.
27. Shemesh M. Actions of gonadotrophins on the uterus. Reproduction,2001,121:835-842.
28. Santos MA, Kuijk EW, Macklon NS. The impact of ovarian stimulation for IVF on the developing embryo. Reproduction,2010,139:23-34.
29. Wissing ML, Bjerge MR, Olesen AI, et al. Impact of PCOS on early embryo cleavage kinetics. Reprod Biomed Online,2014,28:508-514.
30. Costello MF, Misso ML, Balen A, et al. Evidence summaries and recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome: assessment and treatment of infertility. Human Reproduction Open, 2019(1): 1–24.
原创文章:方舟健客版权所有,未经许可不得转载。

