男性迟发性性腺功能减退症(LOH,男性早衰)预防治疗最新专家共识(中)
 黄智龙个人号
黄智龙个人号第七节 治疗与疗效评估
一、治疗
1.一般治疗 研究表明,LOH的发病除了与年龄的增长有密切关系外,还与肥胖,代谢综合征及其他系统性疾病、药物及生活习惯相关。一旦确立LOH的诊断,应注意评估患者是否有相关共虑疾病的存在,针对这些状况进行适当的处理后,一些病例的血清水平可恢复。目前认为肥胖与LOH的发生互为因果关系,对于肥胖或超重的LOH患者,尽管TST可少量减少身体脂肪,但通过对生活习惯的指导以达到稳定的减肥效果仍然是治疗的核心内容。体重变化与血清T水平成反比。而且有研究表明,对于同时患有肥胖症的LOH患者,采用TST后心血管方面的不良反应发生率高于一般患者。
2.睾酮补充治疗(TST) TST是治疗典型男性性腺功能减退症的有效方法。相比其他类型的性腺功能减退,TST对于LOH存在诸多争议。LOH患者的血清T缺乏比较轻微,且无特异性症状,临床上血清T水平降低程度与症状评分的严重程度并不十分吻合,对于血清T低于何切点值时应该进行T补充,目前仍未达成共识。既往由于缺乏大样本的中国人群中的研究数据,关于TST的切点值多参考国外指南。2009年,ISA、ISSAM、EAU、EAA和ASA联合制定的LOH治疗指南认为,血清TT水平若低于8nmol/L(230ng/dl),TST往往能够使患者获益?若血清TT水平处于8~12nmol/L之间,需重复测定血清TT及SHBG水平,并计算FT水平以帮助判断,并在排除其他致病因素与完全知情同意的情况下可以尝试进行TST.目前血清FT水平尚无统一的正常下限值,但一般认为血清FT在225pmol/L(65pg/ml)以下时,是TST的指征。也有共识认为FT低于180pmol/L(52pg/ml)时需要使用TST.2016年来自EMAS的研究数据认为,对于50岁以上的男性,如果同时具备以下3种情况,应该采用TST:①有血清T缺乏的临床表现;②Bio-T或FT水平低下;③不存在TST禁忌证。该研究将LOH的血清T水平定义为TT在11nmol/L(3.2ng/ml)以下并FT在220pmol/L(64pg/ml)以下,这个切点值与2009年多个学会发布的指南存在轻微差异。最近,国内最新一项尚未发表的多中心、大样本临床研究得出的诊断T缺乏的切点值为:TT<8.89nmol/L,cFT<210pmol/L,建议作为中国人群雄激素缺乏的实验室诊断切点值。这一切点值的得出,有望为中国人群TST提供重要的参考依据。
值得注意的是,到目前为止还缺乏关于在大样本的60岁以上的LOH人群中进行TST的疗效及风险的随机、安慰剂对照试验;目前的研究存在样本量少、观察时间过短等问题。因此,临床医生必须在充分了解TST的优点和缺点的基础上做出良好的临床判断,同时必须和患者清楚地讨论TST的风险和收益,并使其充分理解与知情同意后,方可开始TST。治疗开始后,需对患者进行密切随访。
3.TST的禁忌证 前列腺癌及乳腺癌是TST的禁忌证,且通常被认为是绝对禁忌证。在使用治疗前应该评估患者的前列腺癌风险,在前列腺有结节或硬结,或血清PSA水平大于>4ng/ml,或在前列腺癌高风险的人群如非洲人或一级亲属有前列腺癌病史者PSA大于3mg/ml的男性中,未经泌尿外科进一步评估排除前列腺痛之前,禁用TsT.其他禁忌证还包括:血细胞比容大于50%;良性前列腺增生引起严重的下尿路症状(IPSS>19分);未经治疗或控制不佳的充血性心力衰竭及未经治疗的重度睡眠呼吸暂停综合征:有生育需求者。而2015年欧洲泌尿外科学会(EAU)制定的男性性腺功能减退症指南中所列出的睾酮治疗的禁忌证则包括:前列腺癌;PSA>4mg/ml;男性乳腺癌;重度睡眠呼吸暂停综合征;男性不育且积极渴望拥有孩子;血细胞比容>0.54;由于前列腺增生引起的严重下尿路症状;严重慢性心力衰竭/纽约心脏协会分级N级。
关于TST与前列腺癌的关系,早在2009年ISA、ISSAM、EAU、EAA和ASA联合制定的LOH 指南中就指出,目前尚无结论性的证据表明TST增加前列腺癌及良性前列腺增生的风险,也无证据证明TST能促使亚临床型前列腺癌转换为临床可测性前列腺癌。然而,有明确的证据表明T能刺激局部进展性和转移性前列腺癌的生长。因此45岁以上罹患性腺功能减退症的男性在接受TST前应该咨询TST的潜在风险并严密监测前列腺健康状况以确保安全。对于经过成功治疗的前列腺癌合并性腺功能减退症患者,在无临床及生化复发时,是TST的潜在指征。截至目前,这种观点仍未改变。
4.其他治疗 17α-烷基雄激素制剂如甲基睾酮因其肝毒性是已经临床废弃的治疗方法;目前尚无DHT在老年男性中应用的证据;其他非睾酮的雄激素前体制剂DHEA、DHEA-S、雄烯二醇或雄烯二酮不推荐应用。人绒毛膜促性腺激素(hCG)可以刺激Leydig细胞产生T。最近有小样本的为期6个月的临床研究表明,相对于T治疗组,hCG治疗组的LOH患者的血清25-羟维生素D浓度明显升高,血清中的雌素水平明显降低。此外,hCG治疗组的血细胞比容平均值、PSA、前列腺体积较TST组明显降低。TST后患者的精子浓度显著降低,而hCG治疗组则无明显下降。目前关于hCG在老年男性中应用的疗效及不良反应的数据尚显不足,且hCG费用较高,因此仅推荐在有生育需求的LOH患者中使用hCG治疗。抗雌激素制剂及芳香化酶抑制剂可以增加内源性T水平,但目前尚无证据推荐在LOH患者中应用此项疗法。选择性雄激素受体调节剂尚处于开发中,还未进入临床应用。
二、疗效评估
在TST过程中,控制血清T水平的初始目标应该是正常年轻男性参考值的中间水平。
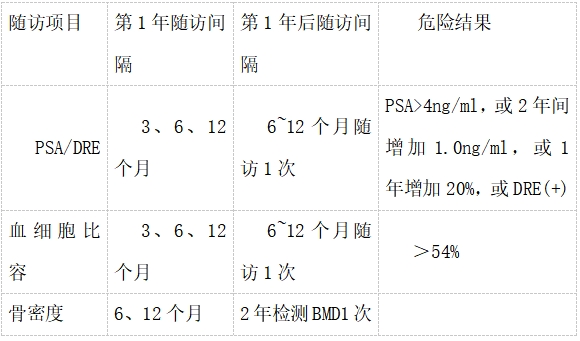
疗效评估包括T缺乏相关症状和体征,如:性欲、性功能、肌肉功能、身体脂肪及骨密度改善情况的评估。如果患者在一个合理的(一般为3-6个月)时间内(性欲、性功能、肌肉功能及身体脂肪在3到6个月内可改善;骨密度的改善则需要2年左右)无明显获益,则应该终止治疗,并再次评估有无其他导致T缺乏症的病因。如果治疗有效,患者应在第3、6、12个月时定期监测血细胞比容、血红蛋白及PSA水平,并做直肠指诊,以后转为每6~12个月监测1次。同时,患者应在第6、12个月时分别监测骨密度,之后第2年时监测一次(随访监测时间详见表11-4)。在治疗与监测过程中,需要考虑到患者可能的自发缓解情况,
应当停药适当的时间后检测患者的症状、血清T水平,以判断患者是否自发缓解。
LOH 雄激素治疗后的随访监测
第八节 不良反应监测
由于睾酮补充治疗期间可能出现各种不良反应(尤其是血细胞比容升高、前列腺癌风险),对LOH患者进行TST时,更倾向于选择短效T制剂。一旦发生不良反应,可及时终止治疗。
1.前列腺癌及乳腺癌 前列腺癌和乳腺癌是TST的绝对禁忌证。前列腺癌高风险的男性是TST的相对禁忌证。45岁以上LOH患者行TST前,至少需行直肠指诊及PSA测定评估前列腺健康状况,治疗过程中需密切监测前列腺安全性。开始治疗后第1年PSA/DRE、血细胞比容随访间隔为3、6、12个月,骨密度随访间隔为6、12个月;第1年后PSA/DRE、血细胞比容随访间隔为6~12个月,2年检测1次BMD;如发现PSA>4ng/ml,或2年间增加1.0ng/ml,或1年增加20%,或DRE(+),血细胞比容>54%,应立即停用雄激素药物,建议进行前列腺穿刺活检,排除前列腺癌。有确切证据表明TST能促进局部进展的前列腺癌和转移性前列腺癌进一步发展、加重病情,对已手术治疗局部前列腺癌,且目前无活动性病变证据(即可检测PSA,直肠指诊异常,骨/内脏转移的证据)的性腺功能减退症男性患者,应谨慎采取TST,治疗应仅限于前列腺癌复发风险低的患者(即Gleason 评分<8;病理分期pT1~2;手术前PSA<10mg/ml),并且应在随访1年之后开始治疗。
对于良性前列腺增生(BPH)患者,虽然目前并没有证据表明TST会加重BPH下尿路梗阻症状,但2009联合指南中仍将症状较为严重的BPH列为TST的相对禁忌证。治疗期间若出现明显排尿梗阻或出现尿潴留时,建议终止TST,按照BPH 诊疗指南进行处理。
2.红细胞增多症
明显的红细胞增多症(血细胞比容>54%)、重度阻塞性睡眠呼吸障碍和充血性心力衰竭患者(心功能IV级),在没有得到切实有效处理之前不得使用TST。在TST治疗过程中,尤其是老年男性用T注射制剂进行TST时,特别是使用超生理剂量T时,可导致红细胞和血红蛋白明显增高,进而使血液黏稠度增加。因此长期使用TST时需对血液与造血系统作定期随访观察。尚不明确是否存在一个关键的阈值,可以不断调节T剂量以保证使血细胞比容低于54%十分必要。如果血细胞比容持续升高,则停用TST,当血细胞比容恢复正常后重新以较低剂量开始治疗。
3.心脑血管系统 TST在增加患者红细胞水平、改善贫血的同时,可能增加血液黏稠度,长期超生理剂量TST引起的肌肉增加和体液潴留,可能对心血管系统造成不良影响,严重时出现高血压、全身水肿和充血性心力衰竭。对已存在心血管疾病、静脉血栓栓塞或慢性心力衰竭的男性性腺功能减退患者,需要谨慎给予TST治疗,上述疾病在TST开始前需要得到有效治疗,并在治疗期间仔细监测与临床评估血细胞比容(不超过54%),尽可能维持血清T水平在相应年龄正常健康范围的中间水平。
4.睡眠呼吸暂停综合征 TST后血清T增加,会对呼吸中枢呼气与吸气的转换发生抑制。性腺功能减退症男性患者,TST可出现睡眠呼吸障碍,并使患者对低氧血症和(或)高碳酸血症刺激所致的通气反应受损。在一项安慰剂对照的T凝胶制剂补充治疗临床试验中发现,对于相对健康的性腺功能减退症病人群,TST不引发或加重睡眠呼吸暂停与低氧血症。对于本身易于产生睡眠呼吸暂停疾病的患者,例如:肥胖男性、老年男性、有慢性气道阻塞性疾病的患者,使用TST尤其要警惕睡眠呼吸暂停的发生。对已患有严重睡眠呼吸暂停综合征的患者,应禁用或慎用TST以防止发生严重呼吸障碍。
5.LOH其他治疗方案的不良反应 ①促性腺激素及其类似物与传统TST相比,因T过量所致的不良反应大为减少。其短期应用会出现轻微的不良反应,如睡眠障碍、乳头触痛及排尿症状(尿频、夜尿增多)等。②脱氢表雄酮(DHEA)治疗虽能一定程度上提高LOH患者血清T浓度,但对T缺乏相关症状的改善相当有限,且短期应用可导致心悸、胸痛、PSA升高等不良反应。③雌激素拮抗剂补充治疗可以提高血清T浓度,改善LOH部分症状,但雌激素过少可能导致骨密度下降,甚至骨质疏松的发生。④选择性雄激素受体调节剂(SARMs)补充治疗可改善LOH患者性功能障碍及不良情绪,并可提高其肌肉量及骨密度,但其可增加潜在的心血管事件风险,并可能导致血细胞比容升高、水钠谐留和一定的肝毒性。

第九节 睾酮补充的益处与风险
一、睾酮补充的益处
1.骨骼 老年男性雄激素水平降低是其骨质疏松发生的主要原因之一。研究认为对于不同年龄的性腺功能减退症患者,TST均能使其骨密度增加。目前大部分研究都支持TST后骨密度有所改善的结论,该作用主要集中在腰椎和股骨颈,骨密度分别增加3%和2%;治疗后骨密度的增加与治疗前血清T水平呈负相关:治疗前血清T水平低于10.5nmol/L,治疗后骨密度增加3.4%±1.2%;如果治疗前小于7nmol/L,治疗后可以增加5.9%±2.2%。
TST增加骨密度的机制是源于T本身,还是通过转化为E2发挥作用目前尚不十分明确。外源性T可能主要通过减少骨重吸收的方式对老年男性起作用,也不排除通过影响成骨过程发挥作用的可能性。也有报道认为雌激素能够减少骨量流失。
2.肌肉 男性在50岁之前,肌肉量比较稳定,而在50岁之后,瘦体量(LBM或非脂肪成分,FFM)每年大约减少0.4kg。这种与年龄相关的化在男性比女性更加突出。骨骼肌的减少比其他肌肉更明显,四肢远端的骨骼肌比近端减少更明显。
一般认为,TST可以增加LBM,改善肌肉力量。研究发现:TST后FFM 较安慰剂和对照组增加,主要集中在四肢,表现为骨骼肌量增加;荟萃分析发现TST治疗后LBM平均增加1.6kg,比基线值增加2.7%。对于治疗后肌容量增加能否改善肌肉力量和运动能力,目前意见尚不统一,可能与判断标准、检测手段不同等有关。比较一致的观点是,TST后的患者多数主观认为运动功能得到改善,并且与治疗前的血清T基线水平成反比。
3.脂肪 目前比较一致的观点是,TST后内脏脂肪将减少。有文献报道,内脏脂肪增加与血清TT水平降低相关;较低的血清T水平可以预测男性发生中心性肥胖。有研究发现TST后3个月,体重和脂肪的体积明显下降,尤其是躯干和腹部的脂肪,其中一个重要的指标就是腹围缩小。
荟萃分析结果认为,TST可以轻度降低总胆固醇,对LDL-C没有明显影响,对HDL-C和甘油三酯也影响不大,但在血清T基线水平偏高的患者HDL-C会有轻度减低。
4.性功能 T在男性性欲、勃起和射精功能等方面发挥重要作用。T缺乏男性常出现性欲低下、勃起和射精功能障碍,采用TST将有助于改善这些症状。其中,T改善性欲低下的作用强于对ED的作用。TST后6周能显著提高IIEF的评分,至少3个月的TST将显著改善患有ED的性腺功能减退症患者的性交满意度。
T通过中枢神经系统的作用调节性欲,对男性的性欲起决定性作用。性腺功能减退症的青年男性使用TST能增加性欲和性生活频率,对性欲低下的老年男性研究也能提高性欲。目前认为T主要是通过影响海绵体平滑肌舒张和改善静脉闭塞发挥调节勃起功能的作用。
TST改善性功能障碍的程度主要取决于性功能障碍的病因。对罹患性腺功能减退症合并ED且对PDE5抑制剂治疗无效的患者,TST能显著改善患者对PDE5抑制剂的敏感性,但对具有正常血清T水平合并ED患者作用不明显。
5.T与代谢综合征 代谢综合征(MS)是以胰岛素抵抗为核心,以腹型肥胖、糖脂代谢异常和高血压为主要表现的一组临床综合征。越来越多的证据显示:男性T水平下降能导致机体对胰岛素敏感性的降低,发生MS的风险增加。
研究发现,20%~64%的肥胖男性血清TT或FT水平降低。MS和2型糖尿病(DM)与血清低T关系密切,故2型DM患者合并性腺功能减低症推荐检测血清T水平。美国内分泌协会推荐2型DM患者常规检测血清T水平。LOH患者合MS和(或)DM,TST不仅可以增加对胰岛素的敏感性,改善性腺功能减退的临床症状,还可能改善代谢状态。TST有助于调控血糖和血脂,显著降低糖耐量异常的LOH患者的死亡率。
T对心血管的影响非常复杂。目前认为,T对心血管系统产生有益或中性的保护作用。
血清低T水平可以增加心血管事件,而血清正常的TT水平和FT水平能显著降低心血管疾病患者的死亡率。
6.精神心理 性激素的受体主要分布在下丘脑和边缘系统,睾酮以游离的形式穿过血脑屏障,可能通过直接作用于中枢神经系统或者通过调节中枢神经系统的多巴胺通路以及5-羟色胺通路发挥作用。研究认为TST影响男性的精神心理变化。一项随机对照试验发现TST能明显改善男性抑郁症患者的抑郁症状,同时对于认知水平和情绪的改善也有明显的积极作用。
但TST影响精神心理的具体机制仍不明确。LOH对老年男性的精神心理影响往往被老年衰老过程以及伴随其他疾病所掩盖或模糊,因此值得重视。
二、睾酮补充治疗的风险
1.前列腺
(1)T与良性前列腺增生(BPH):目前尚无确切证据表明TST增加发生BPH的风险。有文献报道,TST可显著增加性腺功能减退症患者超声检测的前列腺体积,多数在6个月内达到正常人前列腺大小。但在这些研究中,尿流率、残余尿及排尿症状未发生显著变化。
尽管尚无有力证据提示TST会加剧下尿路症状或促使急性尿潴留发生,但个别性腺功能减退症患者进行TST时会加剧排尿症状。2009年多个学会发布的联合指南指出,BPH伴有重度下尿路症状(IPSS评分超过21分)仍是TST的相对禁忌证,下尿路梗阻成功治疗后不再受此限制。
(2)T与前列腺癌:有证据表明,T能促进局部进展及转移前列腺癌肿瘤的生长并剧病情。散在的病例报告提示TST可使隐性前列腺癌转化为临床前列腺癌。
目前尚缺乏有力的证据证明TST会导致前列腺癌,与之相反,越来越多的研究证明低睾酮和前列腺癌相关。45岁以上LOH患者行TST前必须综合分析治疗的益处及风险,治疗过程中需密切监测前列腺安全性。治疗前,至少需行直肠指诊及血清PSA测定评估前列腺癌的风险。此外,还可以结合年龄、家族史及种族等因素。如患者及医生觉得风险很高,则有必要进行进一步检查。但是,没有必要在治疗前常规行前列腺超声或前列腺活检。开始治疗后3~6个月及12个月时应评估前列腺状况,此后每年至少评估1次。如高度怀疑前列腺癌(直肠指诊异常、PSA升高或结合其他因素提示前列腺癌)应考虑行前列腺穿刺活检。一项最新的回归性研究发现,既往患有前列腺癌的LOH患者经过TST后,并未发现总死亡率和肿瘤特异性死亡率的增加,但TST更倾向适用于那些高分化前列腺癌并经过前列腺癌根治术后的患者。
前列腺癌患者有效治疗后诊断为LOH,谨慎观察一段时间后,如临床及实验室检查无肿瘤残留证据,可考虑TST.此时需详细向患者讲解TST的益处和风险并获得患者知情同意,治疗期间需密切随访。
2.肝损害 曾报道烷基化睾酮(如甲基睾酮)有明显肝毒性。该类药物经血液吸收到达肝脏,由于肝脏首关效应,药物在肝脏代谢,导致肝细胞损害,表现为肝功能异常、胆汁淤积甚至肝脏肿瘤,该类T制剂已经在临床上被废弃使用。而现在临床上使用的睾酮酯,无论是口服还是注射剂均无明显的肝毒性。十一酸睾酮胶丸为睾酮衍生物,其溶入植物油中,含有脂肪酸侧链,口服后经淋巴管道吸收,经胸导管进入血液循环,避免了肝脏首关效应与肝毒性。口服十一酸睾酮长达十年的临床安全性评估报道,33例LOH患者均无肝功能异常。
3.红细胞增多症 骨髓造血系统,亦为T靶器官。当给予睾酮治疗时,有轻度贫血的老年男性,TST有利于纠正贫血。而没有贫血的患者,红细胞和血红蛋白会增高,特别是使用超生理剂量TST时,可导致红细胞和血红蛋白明显增高,进而致血液黏稠度增加。
有报道T注射导致红细胞增多症的发生率高达44%,透皮吸收剂的发生率约为3%~15%,口服十一酸睾酮的发生率较低,约为3%~5%。因此,长期使用TST治疗时需对血液与造血系统作随访观察,尤其是定期血液黏稠度的检测。
4.睡眠呼吸暂停综合征 TST后血清T增加,会对呼吸中枢呼气与换气转换发生抑制。
性腺功能减退症男性患者,用TST时可出现睡眠呼吸障碍,并且使患者对低氧血症和(或)高碳酸血症刺激所致的通气反应受损。在一项安慰剂对照的T凝胶制剂补充治疗临床试验中发现,对于本身易于产生睡眠呼吸暂停疾病的患者,例如:肥胖男性、老年男性、对于相对健康的性腺功能减退症患者群,TST不引发或加重睡眠呼吸暂停与低氧血症。
有慢性气道阻塞性疾患的患者,TST时尤其要警惕睡眠呼吸暂停的发生。对已患有严重睡眠呼吸暂停综合征患者,应禁用或慎用TST以防止发生严重呼吸障碍。
5.肿瘤 采用TST时应对肿瘤发生高度关注,尤其关注前列腺癌与乳腺癌等,TST可引起已有乳腺癌病情加重。早年曾有大剂量口服烷基化睾酮致肝细胞癌报道,近年因为烷基化睾酮临床上已不再使用,未再检索到引起肝脏肿瘤报道。
6.精子发生 过度使用TST,会引起下丘脑-垂体-睾丸轴的负反馈抑制,导致精子发障碍。但临床按规范补充一般不会导致精子发生异常,因推荐使用剂量为生理补充剂量,不会导致性腺轴负反馈抑制作用。对性腺功能低下患者,有报道TST可增加精子浓度与活力。
7.脂代谢 睾酮对脂代谢的影响较为复杂,因剂型、剂量和患者体质不同而异。TST可以降低甘油三酯、LDL-C,也有降低或升高HDL-C水平的报告。因此,长期TST时仍需注意患者血脂变化,及时调整用药。
8.心脑血管系统 长期TST需注意观察其对患者心脑血管的影响。近年来许多研究发现,雄激素有抗动脉粥样硬化(AS)的作用,雄激素水平与男性冠心病的发生率呈负相关。随机双盲安慰剂对照研究表明,TST可以显著改善慢性稳定型心绞痛男性患者的心绞痛发作。近年来的资料提示,TST对心血管系统是有益的,但要注意超过生理剂量时所带来的心血管危险。有报道超过生理剂量的TST用于年轻男性可发生心肌缺血和脑卒中。
由于肌肉增加和体液潴留,体重可能少量增加;严重时发生高血压、周围水肿和充血性心力衰竭。在人类心肌细胞存在AR,超剂量的雄激素可以直接引起心肌细胞的肥大。
9.男性乳房发育:在TST过程中有可能出现男性乳房发育,一般不需干预治疗。
第十节 性腺功能低下的共患疾病
LOH是严重影响中老年男性健康和生活质量的重要疾病之一,其往往同时存在多种临床表现,并给多器官、系统的功能带来不良影响。因此,与性腺功能低下相关的共患疾病风险迫切需要得到人们的关注。LOH的主要发病机制是随着年龄增加导致的雄激素水平低下。一项在欧盟8个国家基于社区人群的3200例中老年(40~79岁)男性横断面研究结果表明,与增龄相关的FT每年下降约3.12pmol/L.然而,我国社区人群对LOH及其相关问题的知晓率和认知水平还比较低,积极正确认识性腺功能低下相关的共患疾病风险对于提高中老年男性生殖健康有着极其重要意义。
一、LOH与性功能障碍
雄激素在维持男性正常性欲、阴茎勃起功能和射精功能等方面具有重要作用。雄激素可以通过中枢神经系统的作用调节性欲,在一定范围内,血清T浓度越高,产生性欲的驱动力越强。雄激素可以通过调节AR,影响阴茎勃起的相关酶类,例如:NOS、PDE5 及RhoA/Rho 激酶等的表达以及对海绵体自身结构的影响,参与调控阴茎勃起。欧洲多中心年龄分层随机抽样调查研究结果显示,晨勃次数减少,性欲低下,勃起功能障碍与雄激素水平下降密切相关,血清雄激素水平低下男性性幻想减少的可能性大幅增加。临床研究显示LOH导致的ED以夜间勃起障碍多见。最近有学者认为ED可以作为判断LOH的预后指标之一。对雄激素缺乏男性采用TST能有效改善性欲低下、勃起和射精功能障碍。回顾性分析研究显示TST能提高性腺功能低下男性的性欲,改善睡眠相关的阴茎勃起功能。有文献指出在LOH男性中使用TST能显著改善阴茎勃起功能,并认为是一项安全可靠的治疗策略。
二、LOH与认知功能障碍
LOH患者大多伴随记忆、认知功能的减退,老年性痴呆尤其是阿尔茨海默病在LOH患者中的发病率明显升高。T对认知功能的影响具有选择性和特异性,在一定范围内血清T水平与认知功能呈正相关性。在阿尔茨海默病患者的研究中发现TT水平随着病情的加重而进行性下降,重度阿尔茨海默病患者血清TT水平明显低下。进一步研究发现Bio-T水平与词语记忆、视觉记忆有密切关系,尤其是与视觉空间功能呈正相关性。对阿尔茨海默病中诊断为LOH患者给予TST,可明显改善其认知和视觉空间功能。一项平均随访年限达19年的前瞻性纵向研究显示,在调整年龄、BMI、DM等影响因素后,阿尔茨海默病的患病率与FTI呈负相关,其每增加10nmol/nmol,阿尔茨海默病患病风险下降26%.T改善老年男性阿尔茨海默病和认知功能的机制可能与其抑制β-淀粉样蛋白的沉淀,加速β-淀粉样蛋白的降解并拮抗其毒性作用,防止tau蛋白的磷酸化,增加神经生长因子的表达,调节载脂蛋白E等途径发挥作用。但是,值得注意的是,T只有在一个最佳的范围内对记忆功能的改善较好,过高或者过低都不能具有改善作用。LOH与抑郁症也有密切联系。美国人口登记机构的一项健康问卷调查显示,性腺功能减退症的中年男性更容易出现抑郁症状。另外一项对超过50岁的老年男性研究表明,调整年龄和伴随疾病因素影响后,血清低T水平的中老年男性其抑郁症状发生的比例显著高于血清T水平正常的男性,其原因可能是由于AR基因多态性决定的。而TST则有利于抑郁症状的改善,提高患者生活质量。
三、LOH与骨折
LOH患者容易出现肌力下降,其骨质疏松和骨折发生率明显增加。
性长达13年的观察性临床研究表明,血清低T水平显著增加骨折的风险(老年男性随着血清T水平的降低,跌倒风险呈进行性增加趋势,可能是由于随着血清T水平降低,老年男性进行性肌容量减少,因此减少了肌肉对骨骼的保护作用而增加骨折的风险。有荟萃分析表明前列腺癌患者接受雄激素去势治疗后骨质疏松和骨折的发生率明显增加,而当中老年男性接受TST后其骨密度则明显增加。国外一个大规模的流行病学调查中发现,对于患前列腺癌、生存时间大于5年者,行去势治疗的患者骨折发生率为19.4%,而未行去势治疗患者骨折发生率为12.6%。有研究显示在LOH患者中使用十一酸睾酮补充治疗能有效改善肌肉和关节疼痛,从而提高LOH患者的生活质量。
四、LOH与肥胖
LOH患者往往同时存在肥胖、糖代谢异常、胰岛素抵抗、血脂紊乱和高血压等多种临床表现,目前广泛认为血清低T水平是其共同的病理生理基础。一方面LOH增加了腹型肥胖的风险,血清低水平T可下调腹内脂肪β-肾上腺素能受体数目,使腹内脂肪分解减少,脂蛋白酯酶活性增加,脂肪释放的甘油三酯(TG)增多,腹内脂肪聚集,从而导致腹型肥胖。另一方面肥胖加速诱导了LOH的发生,肥胖时机体内血清瘦素水平会逐渐增加,进而影响下丘脑-垂体-睾丸轴的正常功能,抑制T的生成。在因肥胖寻求治疗的患者中发现LOH的患病率较高,在调整年龄、高血压、糖尿病等影响因素后高内脏脂肪指数(VAI)男性人群中发生性腺功能减退症的风险是低内脏脂肪指数人群的5.88倍,而长期TST则能有效地降低BMI、体重及腹围等肥胖的指标。性腺功能减退症患者中反映体内脂肪组织含量的瘦素水平也较高,而TST后瘦素水平可下降到正常水平。
五、LOH与糖尿病
大量流行病学调查已经表明中老年男性随着年龄增长,血清T水平降低,空腹血糖水平、胰岛素抵抗逐渐升高;血清T水平与2型DM之间存在负相关,有报道在2型DM患者中LOH患病率高达33%。国外学者曾经随机调查2865例40~70岁男性血清低T水平与2型DM之间的关系,发现血清低T水平是胰岛素抵抗和2型DM的独立危险因素,FT水平每下降4ng/dl,未来发生DM风险增加1.58倍。近来的荟萃分析也表明,调整年龄和BMI等影响因素后,血清低T水平仍然是胰岛素抵抗和2型DM的独立危险因素,一方面血清T缺乏可以引起纤溶酶原激活抑制物-1(PAI-1)活性增强引起胰岛素抵抗,另一方面血清T水平降低使肌肉组织的过氧化物酶增殖物激活受体-α(PPAR-α)和脂肪细胞过氧化物酶增殖物激活受体-y(PPAR-y)的表达下调,使胰岛素敏感性降低。在比较前列腺癌患者雄激素剥夺治疗和非雄激素剥夺治疗的研究中发现,雄激素剥夺治疗患者更容易产生胰岛素抵抗并明显增加高血糖的风险,两者间具有直接相关性。TST可明显改善2型DM伴LOH患者的胰岛素抵抗,从而控制血糖和血脂水平,使患者腹部脂肪减少,血糖控制能力明显改善,心血管疾病的危险性降低,其降低血糖及糖化血红蛋白水平的疗效明显优于饮食和运动。睾酮可以降低白介素-6(IL-6)和肿瘤坏死因子(TNF-α)等炎性因子,减少游离脂肪酸释放改善胰岛素的敏感性。国外一项长达11年的随访研究,观察不同血清T水平的中老年男性DM的发病率,认为血清低T水平可以独立地预示DM和MS发生。
六、LOH与血脂异常及代谢综合征
血脂异常及代谢综合征是LOH患者常常并发的临床症状。国内有流行病学研究表明血清中T水平和TC和TG水平之间存在负相关,与HDL-C水平呈正相关。研究发现当前列腺癌患者接受去势治疗后,血清中T水平出现急剧而严重的下降,血清中的TC、LDL-C和TG升高,HDL-C下降,这些变化可能是由于血清T水平下降降低了脂代谢的关键酶(脂蛋白酯酶和肝脂肪酶)的活性,使乳糜微粒和VLDL-C水解减少,脂肪酸释放减少;同时减少肝细胞对脂质的摄取,从而增加了TC,降低了HDL-C。一项长达5年的对261例LOH患者使用十一酸睾酮TST的纵向研究发现,TST后BMI、腹围和体重等肥胖参数下降,TG、TC、LDL-C、血糖以及血压水平降低,HDL-C水平升高。这可能是由于T刺激增加β肾上腺素能受体数量,促进脂肪分解代谢,通过增加脂蛋白脂肪酶和肝脂肪酶活性,降低脂肪合成,使甘油三酯水平降低,HDL-C水平升高。血清T水平降低明显增加男性发生MS的危险,MS患者发生LOH的比例远高于同年龄组的非MS患者。近期流行病学调查表明,血清TT水平与收缩压和舒张压呈负相关,在调整年龄、吸烟、饮酒及BMI的因素影响后,血清TT水平仍然是MS的主要危险因素。一项对照研究发现TST可以明显改善MS的各项参数,腹围减少11cm,糖化血红蛋白下降1.9%,收缩压下降23mmHg。
七、LOH与心血管疾病
目前,国内外绝大多数的研究证明男性患者心血管疾病发病与低水平的内源性T有关,尤其是与Bio-T浓度相关。正常的雄激素水平对于动脉硬化的发生具有保护作用,而血清低水平T与动脉粥样硬化、心律失常、血栓形成、血管内皮功能障碍、左心室功能受损有关。越来越多的证据表明老年男性的血清低T水平是继年龄、肥胖、脂代谢紊乱、胰岛素抵抗等因素之外又一项动脉粥样硬化的独立危险因素,而动脉粥样硬化是大多数类型的心血管疾病的主要病理生理学基础。血清低水平T可能是预测心血管疾病死亡率的指标之一。一项欧洲前瞻性巢式病例对照研究,自1993年至1997年共随机纳入11606例40~79岁男性志愿者,随访至2003年。研究发现,中老年男性研究对象血清T每升高6nmol/L,心血管死亡风险下降19%,血清低T水平可能是心血管疾病的预测指标之一。有研究发现,在亚洲人群中内源性血清低T水平(≤14.2nmol/L)的中年男性发生心血管不良事件风险是正常对照组的4.6倍(HR:4.61;95%CI:1.02~21.4),并认为血清低水平T是冠心病的独立危险因素。越来越多的研究表明低T水平的男性更易患冠心病,其内源性T越低,冠心病严重程度越重。最近一项对395例45~74岁LOH患者人群研究发现,性腺功能减退症患者ED严重程度与心血管疾病风险呈正相关。目前TST能否减少性腺功能减退症男性患者发生心血管事件的风险目前还存在争论,但是没有足够的研究证据显示TST和不良心血管事件之间有明显关联。现有的大多数研究认为T对心血管系统产生有益或中性的保护作用。动物实验和临床研究也已经证实在冠状动脉内注射T制剂后能使冠状动脉管径和血流速度明显增加。T具有直接扩张冠状动脉作用,其机制可能是T通过对细胞膜上的钾离子通道和钙离子通道的调节使血管扩张,另一方面与AR结合促进血管内皮细胞NO释放,扩张冠状动脉血管,改善血流。目前大多数学者认为TST在男性并发心血管疾病的危险因素的LOH患者中使用是安全有效的,TST可增加老年男性的血管内皮功能,舒张冠状动脉,缓解老年男性心绞痛症状,改善心肌缺血,改善心衰患者的心脏射血功能和相应的临床症状。但是也有个别报道得出不同结果,一项对209例65岁以上合并高血压、糖尿病、高血脂、肥胖等疾病伴有低TT水平(3.5~12.1nmol/L)的老年男性(平均年龄74岁)接受较大剂量的T凝胶进行TST,研究因治疗组的心血管事件发生率较安慰剂组明显增高,临床试验被提前终止。值得指出的是,该项研究样本量小和纳入人群的独特性妨碍了本研究的外延性与参考价值。因此,需要更加大量的、前瞻性、随机对照研究来评估TST和心血管疾病风险的安全性,更加谨慎对TST进行综合评价,包括对剂量与剂量的评价,尤其是对TST应用超过生理剂量时所带来的心血管危险应予以注意。

八、LOH与贫血
雄激素能直接刺激骨髓干细胞和通过肾脏合成促红细胞生成素使红细胞数量和血红蛋白水平增高,血清T缺乏可以导致贫血。国外一项对239例慢性肾脏病患者(46~63岁)的临床研究中发现血清T缺乏患者(TT<10nmol/L)的贫血(Hb<13.0g/dl)风险比血清T未缺乏患者(TT>10nmol/L)高5.3倍。
九、LOH与LUTS
LOH患者也是下尿路症状(LUTS)高发人群。国外一项超过500例LOH患者的研究表明,轻度LUTS发病率为25%,中度为53.3%,重度为22.8%,并且ED程度和LUTS的严重程度呈正相关,LUTS的严重程度是一个独立于年龄之外的LOH危险因素。国内一项研究发现,对LOH患者口服十一酸睾酮12周后,IPSS评分及最大尿流率均明显得到改善。这可能是由于外源性T通过调节尿道上皮和膀胱上皮中广泛存在AR,从而调节逼尿肌兴奋性,降低逼尿肌压力,改善最大尿流率、排尿量以及膀胱顺应性,提高膀胱容量,同时NO也参与尿道和膀胱颈的扩张,松弛泌尿生殖器官平滑肌。一项对261例平均年龄58岁的LOH患者进行长达5年TST的研究显示,前3个月IPSS评分显著下降并在随后5年的治疗过程中持续改善。有文献报道,TST增加了LOH患者超声检测的前列腺体积,但是目前没有充足的证据表明TST加剧下尿路症状或促使急性尿潴留发生。
十、LOH与死亡风险增加
欧盟8个国家实施分层抽样获取2599例,年龄为40~79岁一般人群的研究结果表明,在中位数为4.3年的随访期中共有147例男子死亡,55例(2.1%)被确定为LOH(中度31例,重度24例)。在调整了年龄、各研究中心、BMI、吸烟,和较差健康状况后,重度LOH男性死亡率是正常男性的5.5倍(HR:5.5;95%CI:2.7~11.4).多变量调整后,血清TT低于8nmol/L男性与正常人相比死亡风险高2倍(HR:2.3;95%CI:1.2~4.2),而合并性功能障碍的男性与正常人相比死亡风险高3倍(HR:3.2;95%CI:1.8~5.8).最近的一项血清T水平与死亡率的关系的荟萃分析,包括12项研究和超过16000名男性研究对象的结果证实,血清低T水平的男性死亡率是正常血清T水平男性的1.35倍(HR:1.35;95%CI:1.13~1.62).与正常血清水平的男性相比,轻度和重度血清T水平低下男性有着较高的死亡率和较少的生存时间。国外有研究发现TT水平每下降2.1个标准差时,其心血管病死亡率风险增加了约25%.在国外另外一项观察性研究中,研究对象为1031名年龄40岁以上男性退伍军人,对其中低血清T(<8.7nmol/L)和无前列腺癌史的398名男性采用TST,发现在调整年龄、体重指数、血清T水平、医疗并发症、DM、冠心病等多变量因素后,TST与降低死亡风险明显相关(HR:0.61;95%CI:0.42~0.88)。
随着老龄化社会的到来,正确认识和重视LOH共患疾病风险,做到早期预防,早期治疗,将有利于这一系列慢性病、老年病得到及早防治,将大大提高人民群众的生活质量。
第十一节 中老年生殖健康与保健
WHO将生殖健康定义为:“在生命的所有阶段,生殖系统及其功能和过程所涉及的一切事宜,包括身体、精神和社会适应性等方面的完好状态,而不仅仅指没有疾病或虚弱”。
在开罗召开的联合国国际人口与发展大会(ICPD)提出了与生殖健康相应的生殖保健的定义:“通过预防和解决生殖健康问题,综合各种方法、技术和服务,促进生殖健康和幸福”。在以往的工作和研究中,对女性的生殖健康和生殖保健服务需求和利用的关注较多,各国都设有各种各样私立或公立的妇女和儿童保健中心,但很少有以男性为服务对象的相应机构。关注男性生殖健康,开展男性生殖保健服务,将成为生殖保健领域一项新的重要任务和工作重点。
我国是人口大国,也是世界上老年人口最多的国家。随着物质生活水平大大提高,中老年人提高生活质量的要求越来越强烈,如何提高中老年人的身体健康水平,改善生殖健康状况,提高生命质量、生活质量是生殖健康医务工作者责无旁贷的任务。更年期是人类从中年进入到老年的过渡期。对男性更年期,医学界争论了多年,目前意见已趋于一致,认为男性亦存在更年期。如同女性,此时期的男性同样会出现许多心理上和机体上的功能紊乱。但与女性更年期雌激素骤降不同,中老年男性更年期时,其雄激素水平会出现增龄性缓慢下降,且只有部分雄激素缺乏的中老年男性会出现相应的临床症状,即男性迟发性性腺功能减退症(LOH)。
一、饮食、运动与LOH
生活方式对体弱、肥胖、老年男性(≥65岁)性激素的影响:结果显示,在体弱、肥胖、老年男性,通过生活方式的干预减轻体重,能特异性减少血清总雌二醇、游离雌二醇水平。但是,血清TT水平没有临床意义的增加,FT水平也没有特异性增加。除了生活方式的干预,为了改善这些患者的激素情况,其他的治疗也是需要的。
147例44岁以上的男性参加了专家Cardarelli等的横断面研究,结果显示:参与者平均FT的水平3.1ng/ml(SD=1.5),平均年龄为56.8岁(SD=7.9),多元画归分析提示FT值与年龄和饮食显著相关。很多研究成果都表明,运动能够增加人体骨量和改善其性激素水平。
为了评估长期太极拳练习对体成分及性激素和骨矿物质密度的影响,李天乐等对50名男性中老年太极拳练习者和50名不经常参加运动的对照组人员进行了体成分与骨矿物质密度测试,并且抽样选取了部分人员进行血清T的测试。结果表明,太极拳组和对照组的血清T值分别为5.43μug/L和4.53μg/L,差异具有显著性(P<0.05),说明太极拳锻炼可以延缓雄激素的衰减。
二、中医药与LOH
中医文献中虽然没有明确提出LOH这一病名,但从它的症状表现上来看,属于“不寐”、“郁证”、“阳痿”、“心悸”、“虚劳”、“眩晕”等范畴。《素问·上古天真论》:“丈夫八岁,肾气实,发长齿更,二八,肾气盛,天癸至,精气溢泻,阴阳和,故能有子,三八,肾气平均,筋骨劲强,故真牙生而长极,四八,筋骨隆盛,肌肉满壮,五八,肾气衰,发堕齿槁,六八,阳气衰竭于上,面焦,发鬓斑白,七八,肝气衰,筋不能动,八八,天癸竭,精少,肾脏衰,形体皆极,则齿发去。”指出了天癸在男性生长发育中所起的重要作用。LOH病因病机复杂、证型繁多。熊勇平认为本病有肾阴亏虚型、肝肾阴虚型等10种证型。贾金铭认为本病可分为阴虚内热型(以血管运动症状为主)、肾阳亏虚型(以生理体能症状为主)等8种证型。
将LOH主要综合征分别与四大脏腑对应起来,有利于非中医专业背景医师更好地理解本病的中医诊治规律。如对于阴虚内热证(以性功能障碍症状和血管舒缩症状为主要表现)的患者,因性功能障碍综合征从“肾”论治,血管舒缩综合征提示机体“阴虚”状态,故治疗上应以滋肾阴降虚火为主,可选用知柏地黄汤加减。对于脾肾阳虚证(以性功能障碍症状和生理体能症状为主要表现)的患者,因性功能障碍综合征从“肾”论治,生理体能综合征从“脾”论治,故应补益脾肾,可选用还少丹加减。对于肝郁肾虚证(以性功能障碍症状+情志精神症状为主要表现)的患者,因性功能障碍综合征从“肾”论治,情志精神综合征从“肝”论治,故应从补肾与疏肝解郁同时着手。偏阴虚火旺时可选用六味地黄丸合丹栀逍遥丸;偏阳虚时选用金匮肾气丸合逍遥丸。
有学者观察麒麟丸联合十一酸睾酮胶丸治疗LOH患者的临床疗效。将符合纳入标准的63例LOH患者随机分为对照组(十一酸睾酮胶丸)、联合组(十一酸睾酮胶丸+麒麟丸),分别比较组内和组间治疗前后的IIEF-5评分、AMS评分及血清TT.结果显示,联合组治疗后IIEF-5评分、AMS评分及TT值分别为(21.7±5.8)分、(20.7±5.7)分和(16.7±2.2)nmol/L,均显著高于治疗前(10.6±3.4)分、(40.5±8.3)分和(9.1±1.7)nmol/L,(P<0.05);且明显优于对照组治疗后的(15.9±4.7)分、(31.3±6.5)分和(13.1±2.8)nmol/L,(P<0.05)。因此认为,麒麟丸联合十一酸睾酮胶丸治疗LOH的疗效比单用十一酸睾酮胶丸治疗效果更显著,且不增加不良反应发生率。在国家“十二五”科技支撑计划课题“更年期生殖健康现状评估及健康指导”的研究方案中,已将接受干预治疗的LOH患者分为十一酸睾酮软胶囊治疗组,十一酸睾酮软胶囊加麒麟丸治疗组。两组疗程均为6个月,观察协同作用,该干预研究正在进行中。
许亮等探讨复方玄驹胶囊联合十一酸睾酮胶丸治疗LOH疗效及安全性,结果显示:短期内单用十一酸睾酮胶丸治疗或加用复方玄驹胶囊也能明显提高患者血清T水平,改善患者的临床症状;
联合组的疗效更显著,不增加不良反应发生率;且能减少十一酸睾酮胶丸的用量和时间,并降低TST的风险。
有学者观察针刺结合小剂量的补肾胶囊治疗中老年男性雄激素缺乏患者的临床疗效,结果表明治疗前患者血清T水平明显低于正常男性,治疗后3组患者血清T含量较前有显著性提高。
医生投稿:文章来源于医生投稿,内容仅代表作者个人观点,不代表本平台立场,转载请联系原作者。