宫腔镜切除术联合LNG—IUS治疗子宫内膜息肉的临床作用研究
 王婧个人号
王婧个人号宫腔镜切除术联合LNG—IUS治疗子宫内膜息肉的临床作用研究
王婧1 王洪丽2 陈美华1 王文玲3 陆萍1Δ
(1 新疆维吾尔自治区人民医院妇科 新疆维吾尔自治区 830000;2 新疆维吾尔自治区人民医院检验科 新疆维吾尔自治区 830000;3 新疆维吾尔自治区人民医院妇产科研究室 新疆维吾尔自治区 830000)
摘要
目的:探讨宫腔镜息肉切除术联合LNG-IUS治疗EP的临床作用机制。方法:选取我院妇产科在2019年12月至2020年12月收治的60例EP患者作为研究对象,根据手术方式分为对照组与联合组,每组30例。对照组采用宫腔镜下息肉切除术治疗,联合组以对照组为基础,联合LNG-IUS治疗。对比两组患者临床疗效,治疗后子宫内膜厚度、复发率、内分泌激素(ER、PR)以及炎症相关因子(VEGF、TGF-β1、TNF-α、CRP、IL-6)变化情况。结果:术后,联合组总有效率优于对照组(P<0.05);术前,两组患者子宫内膜厚度对比无差异(P>0.05)。与术前相比,术后两组患者子宫内膜厚度减小。联合组术后各阶段子宫内膜厚度均较对照组小(P<0.05);术前,两组患者各项指标水平变化无明显差异(P>0.05)。术后,联合组VEGF、TGF-β1、TNF-α、CRP、IL-6、ER、PGR水平均优于对照组(P<0.05);术后12个月内,联合组总复发率为6.66%,对照组总复发率为33.33%,联合组优于对照组(P<0.05)。结论:宫腔镜电切术联用LNG-IUS其机制可能与下调ER、PR、VEGF、TGF-β1、TNF-α、CRP、IL-6的表达水平有关,提高子宫内膜息肉治疗效果,降低复发率,为EP的诊疗及相关机制研究提供理论依据。
关键词:左炔诺孕酮宫内缓释系统;子宫内膜息肉;炎症因子;宫腔镜子宫内膜息肉电切术
中图分类号:R711.74 文献标识码:A 文章编号:1673-6273(2022)
Clinical Effect of Hysteroscopic Resection Combined with LNG-IUS in the Treatment of Endometrial Polyps
WANG Jing1,WANG Hong-li2,CHEN Mei-hua1,WANG Wen-ling3,LU Ping1Δ
(1 Department of gynecology,Xinjiang Uygur Autonomous Region People's Hospital,Xinjiang Uygur Autonomous Region,830000,China;2 Department of Clinical laboratory,Xinjiang Uygur Autonomous Region People's Hospital,Xinjiang Uygur Autonomous Region,830000,China;3 Department of obstetrics and gynecology Laboratory,Autonomous Region People's Hospital,Xinjiang Uygur Autonomous Region,830000,China)
ABSTRACT Objective: To investigate the clinical mechanism of hysteroscopic polypectomy combined with LNG-IUS in the treatment of EP. Methods: A total of 60 EP patients admitted to the Department of Obstetrics and Gynecology of our hospital from December 2019 to December 2020 were selected as the research objects, and divided into matched group and joint group according to the manipulation method, with 30 cases in each group. The Matched group was treated with hysteroscopic polypectomy, and the joint group was treated with LNG-IUS on the basis of the matched group. The clinical efficacy, endometrial thickness, recurrence rate, endocrine hormones (ER, PR) and inflammation-related factors (VEGF, TGF-β1, TNF-α, CRP, IL-6) were compared between the two groups after treatment. Results: After operation, the total effective rate of the joint group was was better than the matched group (P<0.05). Before operation, there was no significant difference in endometrial thickness between the two groups. (P>0.05). After operation, the endometrial thickness of the two groups was significantly reduced compared with that before operation. The endometrial thickness in the joint group was smaller than that in the mtched group at each stage after operation (P<0.05); Before operation, there was no significant difference in the changes of various index levels between the two groups (P>0.05). After operation, the levels of VEGF, TGF-β1, TNF-α, CRP, IL-6, ER and PGR in the joint group were better than those in the matched group (P<0.05); Within 12 months after operation, the total recurrence rate of the joint group was 6.66 %, the total recurrence rate in the Matched group was 33.33 %, and the joint group was better than the matched group (P<0.05). Conclusion: The mechanism of hysteroscopic resection combined with LNG-IUS may be related to the down-regulation of the expression levels of ER, PR, VEGF, TGF-β1, TNF-α, CRP, and IL-6, and to improve the treatment effect of endometrial polyps. Reduce the recurrence rate and provide a theoretical basis for the diagnosis and treatment of EP and related mechanism research.
Key words: Levonorgestrel-releasing intrauterine system; Endometrial polyps; Inflammatory factors; Hysteroscopic resection of endometrial polyps
Chinese Library Classification(CLC): R711.74 Document code: A
Article ID:1673-6273(2022)
前言
子宫内膜息肉(Endometripolyp, EP)在不孕症妇女中发病率较高,是一种发生在子宫内膜基底层的局灶性增生[1]。
临床表现为:月经量增多、经期延长、不规则阴道出血等,严重者甚至诱发癌变。据报道,子宫内膜息肉恶变率高达6 %,与子宫内膜癌发病相关,严重影响患者生命健康[2]。当前临床针对子宫内膜息肉尚无特效药物,多采用手术治疗。宫腔镜下息肉电切除术是治疗子宫内膜息肉的主要手段,其优势为定位准确、安全性高等[3-4]。但息肉切除术后息肉复发率仍为2.5~44 %,EP术后复发是临床医生长期决策关注的问题[5]。子宫内膜息肉发病机制尚不知晓[6-7],但已有相关研究发现:子宫内膜息肉的产生和复发与患者子宫内炎性因子异常表达,雌激素和孕激素发生代谢异常,雌激素以及孕激素受体之间比例发生失衡等因素有关[8-9]。左炔诺孕酮宫内缓释系统(LNG-IUS)是一种含有高效价左炔诺孕酮的宫内缓释系统,可在宫腔内缓慢且稳定释放孕激素,对子宫内膜雌激素受体表达与细胞因子表达产生抑制作用,进而抑制子宫内膜增生[10-11]。
现有研究表明,宫腔镜电切术与LNG-IUS联合使用疗效显著,在减少月经量、子宫内膜厚度方面效果显著,安全可靠且不易复发[12-13]。因此,本研究选取我院妇产科在2019年12月至2020年12月收治的60例EP患者,探讨宫腔镜息肉切除术联合LNG-IUS治疗EP的临床作用机制,具体报告如下。
1 资料与方法
1.1 一般资料
选取新疆维吾尔自治区人民医院妇产科在2019年12月至2020年12月收治的60例EP患者,依照手术方式的不同分为宫腔镜下息肉切除术组(即对照组,n=30例)及其联合LNG-IUS治疗组(即联合组,n=30例)。
纳入标准:1)纳入病例均符合EP的诊断标准;2)近期无生育要求的妇女;3)年龄20 ~50岁;4)知情同意参加本研究者。
排除标准:1)有妇科肿瘤、盆腔结核和子宫内膜异位症的患者;2)有药物过敏史、精神疾病或子宫内膜异位症的患者。3)心脏、肝脏、肺、肾等严重器质性疾病患者;4)知情不同意参与本研究者。
1.2 方法
对照组患者行宫腔镜手术前均未行内膜预处理。术前3h阴道放置米索前列醇400 ug,以软化宫颈。单发息肉切除根蒂后完整取出。对照组患者取膀胱结石位,常规消毒阴部后,放阴道窥器,探宫腔位置及大小,并放入10 mm宫腔镜,给予子宫内膜息肉电切除术,完成常规病理学检查。
联合组在对照组的基础上联合LNG-IUS治疗。在对照组手术方法结束后,患者第一次月经来潮时放置LNG-IUS(生产企业:Bayer Oy,国药准字:J20140088,规格:52 mg/个)。
1.3 观察指标
1.3.1 观察两组患者临床疗效 评判标准:显效:患者月经量恢复正常,临床症状消失,影像学显示子宫内膜厚度恢复正常;有效:患者月经量减少,痛经、子宫不规则出现以及腹痛等临床症状有所缓解,影像学显示子宫内膜厚度变小;无效:患者临床症状均无变化或加重。显效率+有效率=总有效率。
1.3.2 观察两组患者手术前后子宫内膜厚度 采用彩色多普勒超声对患者术前、术后3个月、术后6个月以及术后12个月的子宫内膜厚度进行测量。
1.3.3 观察两组患者治疗前后炎性因子水平变化情况以及内分泌激素变化情况 在治疗前后分别取患者清晨空腹4ml肘静脉血,离心后取上层血清,置冰箱内保存。采用ELISA法对患者血管细胞生长因子(VEGF)、白介素-6(IL-6)、血清C反应蛋白(CRP)以及肿瘤坏死因子α(TNF-α)进行测定。采用免疫组织化学法对患者雌激素受体(ER)、黄体酮受体(PGR)进行测定。
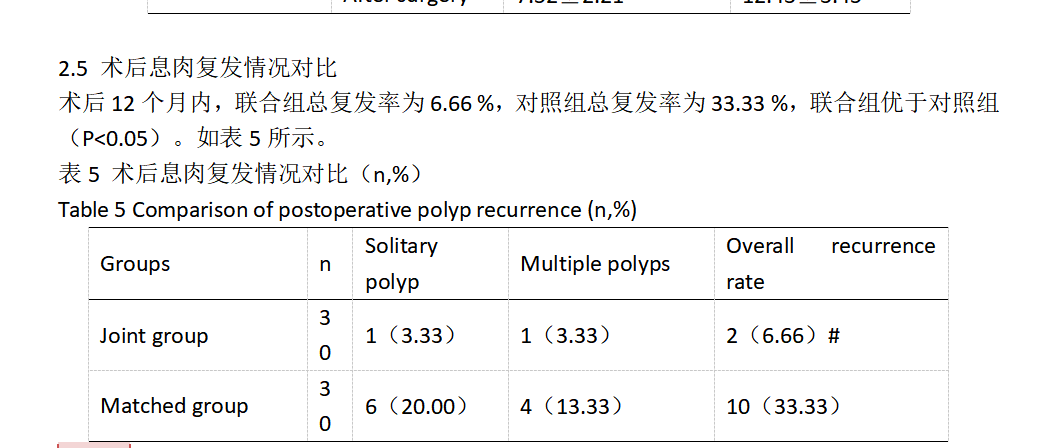
1.3.4 观察两组患者术后息肉复发情况 术后随访,叮嘱患者每6个月来院复查,观察术后恢复情况以及息肉复发情况。通过彩超复查,观察子宫内膜是否有异常回声,再经病理确定息肉是否复发。
1.4 统计学方法
应用SPSS 22.0,使用(`x±s)示计量资料,采用t检验,使用[n(%)]示计数资料,应用卡方检验,P<0.05有统计学意义[13]。
2 结果
2.1 一般临床资料对比
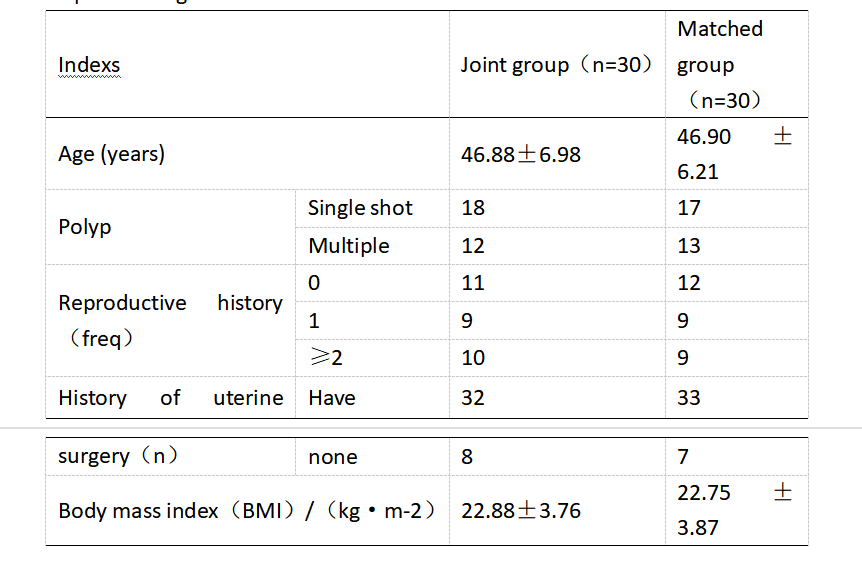
两组年龄、病理类型、生育史、子宫手术史以及体质量指数等基本资料对比无明显差异(P>0.05),有可比性,如表1所示。
表1 一般临床资料对比
Table 1 Comparison of general clinical data
 2.2 临床疗效对比
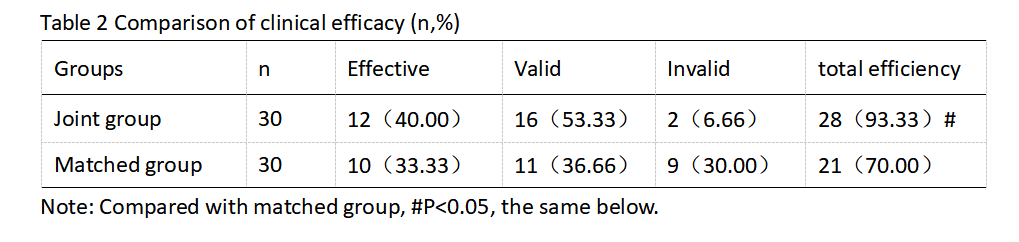
2.2 临床疗效对比术后,联合组总有效率为93.33 %,对照组总有效率为70.00 %,联合组明显优于对照组(P<0.05)。如表2所示。
表2 临床疗效对比(n,%)
 3 讨论
3 讨论近些年,随着生活水平及方式不断提高及改变,子宫内膜息肉呈上升及年轻化趋势[14-15]。据报道,肥胖、高血压等因素与子宫内膜增生息肉息息相关,激素紊乱也可导致疾病高发[16-17]。此外,有报道显示子宫内膜息肉的发生与局部子宫内膜ER或PR表达失衡关系密切[18]。劳芝英等研究表明,高水平雌激素和孕激素转化相对缺乏,会提高子宫内膜息肉的发病率,引起子宫内膜增生[19]。宋小琳等研究报告发现长期药物、机械刺激所导致的炎症会引发子宫内膜增生,进而不断形成子宫内膜息肉[20]。但有关子宫内膜息肉的发病机制尚不完全清楚,缺少特异性强的治疗手段,预后效果欠佳[21]。LNG-IUS属于新型宫内节育器,可通过较高水平的孕激素对患者子宫内膜形成缓慢的抑制作用,有效预防息肉复发,但其作用机制仍未明确[22]。因此,本研究探讨宫腔镜息肉切除术联合LNG-IUS治疗EP的临床作用机制。
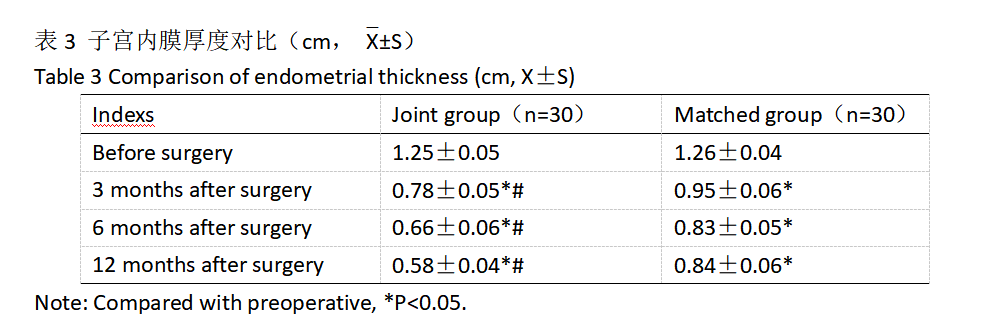
本研究结果显示,术后,联合组总有效率为93.33 %,对照组总有效率为70.00 %,联合组明显优于对照组(P<0.05);术前,两组患者子宫内膜厚度对比无差异(P>0.05)。术后两组患者子宫内膜厚度较术前减小。联合组术后各阶段子宫内膜厚度均较对照组小(P<0.05);由此证明,宫腔镜息肉切除术联合LNG-IUS治疗EP临床疗效明显。这是因为,子宫内膜息肉是子宫内膜基底层的局限性增生,有蒂突向子宫腔,由少量致密的纤维结缔组织组成的间质、管壁较厚的血管及子宫内膜腺体组成。随着医学的发展,微创手术的普及与应用,宫腔镜息肉切除术在治疗EP的过程当中优势明显,具有出血量少、手术安全等优势[23]。术后放置LNG-IUS,该系统以高效孕激素的局部作用机制为核心,LNG-IUS放入体内后,可释放左炔诺孕酮,可持续维持局部药效浓度,具有显著抑制子宫内膜作用,使子宫膜腺体萎缩,基质水肿及蜕膜化,黏膜变薄,内膜上皮成为单层柱状立方上皮,螺旋小动脉管壁增厚,毛细血管血栓形成甚至出现局灶性间质坏死[24]。
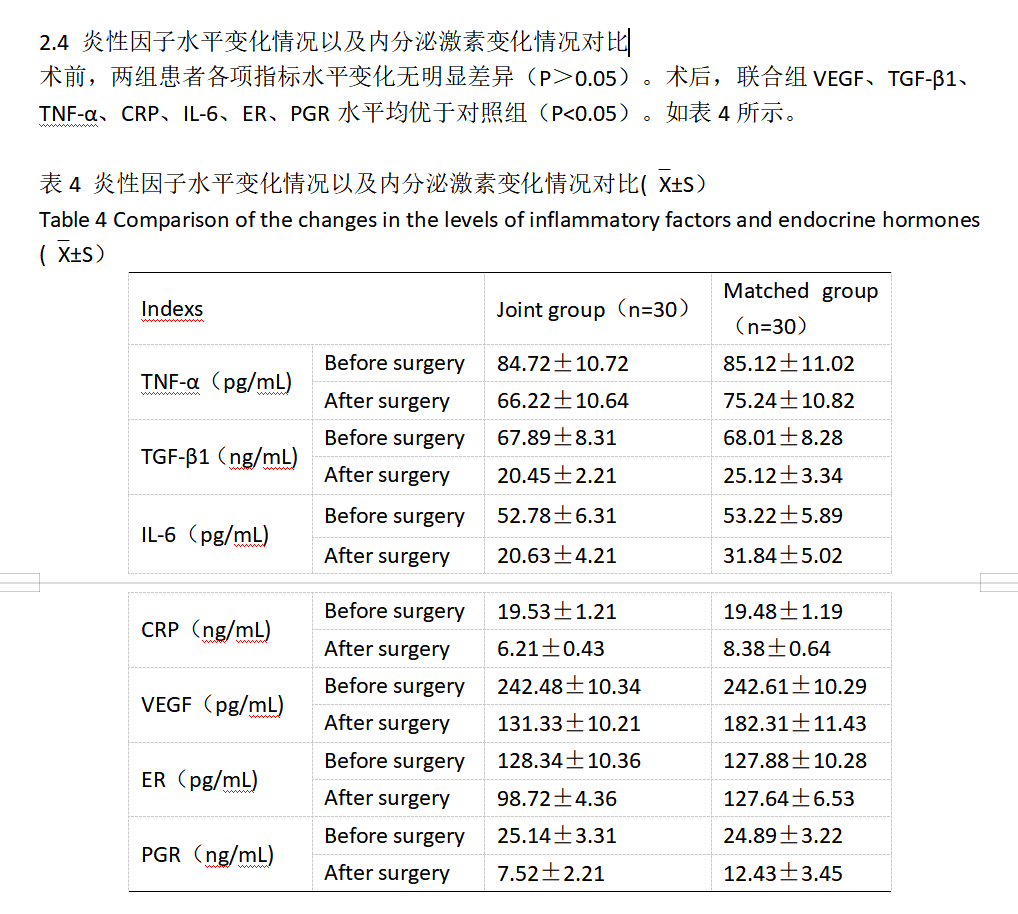
本研究结果显示:术前,两组患者各项指标水平变化无明显差异(P>0.05)。术后,联合组VEGF、TGF-β1、TNF-α、CRP、IL-6、ER、PGR水平均优于对照组(P<0.05);术后12个月内,联合组总复发率为6.66 %,对照组总复发率为33.33 %,联合组优于对照组(P<0.05)。
由此证明,宫腔镜息肉切除术联合LNG-IUS治疗EP可有效降低ER、PR、VEGF、TGF-β1、TNF-α、CRP、IL-6的表达水平,降低复发率。这是因为,ER是一种糖蛋白,可通过与雌激素特异性结合,调节下游因子的转录、复制,促进细胞增殖与分化。PR可与孕激素特异性结合,改变构象,对子宫内膜增殖产生抑制作用[16]。在本次研究中,联合组中ER和PR同时降低,其相关原因可能为:LNG-IUS通过下调ER、PR表达进而调整性激素受体在子宫内膜表达的不平衡状态[25]。VEGF是促血管生长因子,有利于血管新生和基质细胞生长[26]。临床病理活检中诊断子宫内膜息肉的主要标志为子宫内膜间质的增生伴厚壁血管生成,VEGF可参与子宫内膜息肉的发生、发展,该因子的过表达将会诱导组织中新生血管过度增生,进而诱导局部内膜异常增生,从而形成息肉[27-28]。TGF-β1是一类多功能因子,可以调控细胞的生长和分化,是新生血管必需的生长因子。该因子的过表达会刺激肌纤维母细胞、胶原蛋白等的生成,抑制细胞外基质的降解,促使血管新生、基质细胞生长、宫内膜纤维化,诱导子宫内膜的异常增生,最终导致子宫内膜息肉的产生[28]。在本次研究中,联合组中VEGF和TGF-β1表达水平的降低,可以抑制新生血管过度增生,防止息肉的形成。TNF-α在炎症反应、免疫反应、细胞增殖凋亡等程序中发挥重要的作用,TNF-α可以通过调控局部炎症反应,杀伤靶细胞,促进细胞凋亡,同时可以通过调控血管新生,诱导子宫内膜间质细胞增生和炎性因子的产生。CRP是一种急性时相蛋白,TNF-α的高表达会促进CRP的产生。IL-6也称B细胞刺激因子,是具有多种生物活性的细胞因子,由促溶酶体酶及超氧化物释放的炎性因子,这三者水平升高代表患者炎症反应加重[29]。已有研究表明[30],TNF-α、CRP和IL-6等因子参与子宫内膜炎症反应过程,诱导子宫内膜增生性病变,提高息肉复发风险,控制患者炎症水平对于预防术后复发意义重大。在本次研究中,联合组中TNF-α、CRP和IL-6表达水平的降低,可有效降低子宫内膜增生性病变和息肉复发风险。
综上所述,宫腔镜电切术联用LNG-IUS可显著降低ER、PR、VEGF、TGF-β1、TNF-α、CRP、IL-6的表达水平,提高子宫内膜息肉治疗效果,降低复发率,其机制可能与下调雌、孕激素受体,生长因子和炎性因子有关,为EP的诊疗及相关机制研究提供理论依据。
参考文献(References)
Molnár S, Farkas Z, Jakab A, et al. Effectiveness of different methods for polypectomy in the menopause: a retrospective study[J]. Climacteric, 2020,23(4):325-329.
Romero S A ,Young K ,Hickey M , et al. Levonorgestrel intrauterine system for endometrial protection in women with breast cancer on adjuvant tamoxifen[J]. Cochrane Database Syst Rev, 2020,12(12):1002.
Ceci O, Franchini M, Cardinale S, et al. Comparison of endometrial polyp recurrence in fertile women after office hysteroscopic endometrial polypectomy using two widely spread techniques[J]. J Obstet Gynaecol Res, 2020,46(10):2084-2091.
Ciscato A, Zare SY, Fadare O. The significance of recurrence in endometrial polyps: a clinicopathologic analysis[J]. Hum Pathol, 2020,100(5):38-44.
Cea García J, Jiménez Caraballo A, Ríos Vallejo MDM, et al. Retrospective cohort study on the symptomatic recurrence pattern after hysteroscopic polypectomy[J]. Gynecol Minim Invasive Ther, 2020,9(4):209-214.
屠文骆, 王淼, 邱丽雅. VEGF Ki-67及 MMP-9 在子宫内膜息肉中的表达特点及意义[J]. 中国妇幼保健, 2021, 36(7): 1626-1629.
Takeda, Banno, Kobayashi, et al. Mutations of RAS genes in endometrial polyps[J]. Oncol Rep, 2019,10(2):26-28.
Chan C W, Eisenstein D I, Abood J, et al. Effectiveness of Hysteroscopic Morcellation of Endometrial Polyps Compared to Traditional Technique: A Comparison of Disease Recurrence[J]. J Mini Invas Gynecol, 2020,27(7):S142.
李经纬, 顾荣华, 王颖娴, 等. 宫腔镜电切术联合LNG-IU治疗子宫内膜息肉效果及炎症因子变化[J]. 中国计划生育学杂志. 2020, 28(6):823-826.
Strickland K C, Yuan L, Quade B J, et al. Clinicopathological and immunohistochemical features of uterine adenomyomatous polyps[J]. Hum Pathol, 2019,239(84):245.
何秀宣, 李标, 李沙沙. 宫腔镜电切术联合左炔诺孕酮宫内缓释系统治疗子宫内膜息肉疗效及对雌激素受体和孕激素受体表达的影响[J]. 中国性科学. 2020, 29(10): 106-110.
Luerti M, Vitagliano A, Sardo A, et al. Effectiveness of Hysteroscopic Techniques for Endometrial Polyp Removal: The Italian Multicenter Trial[J]. J Minim Invasive Gynecol, 2019,26(6):1169-1176.
周冠伦, 张宁, 李菲. 子宫内膜息肉发病机制及临床诊疗策略的相关研究进展 [J]. 中国妇幼保健, 2019, 34(7): 1681-1683.
Wong C, So P L. Prevalence and risk factors for malignancy in hysteroscopy resected endometrial polyps[J]. Int J Gynaecol Obstet, 2021,155(3):433-441.
Feng M, Zhang T, Ma H. Progesterone ameliorates the endometrial polyp by modulating the signaling pathway of Wnt and β‐catenin via regulating the expression of H19 and miR‐152[J]. J Cell Biochem, 2019,120(6):10164-10174.
Strickland K C, Yuan L, Quade B J, et al. Clinicopathological and immunohistochemical features of uterine adenomyomatous polyps[J]. Hum Pathol, 2019,239(84):245.
Dibi R P, Zettler C G, Vanin C, et al. Immunohistochemical assessment of symptomatic postmenopausal endometrial polyps in tamoxifen users and nonusers: a case control study[J]. Sao Paulo Med J, 2020,138(3):1590
Chen Q, Zhang D, Wang S, et al. A prospective, open-label, single-arm study to evaluate the efficacy of dydrogesterone in the treatment of endometrial polyps[J]. Gynecol Endocrinol, 2020,37(6):1-5.
Pintican R, Bura V, Zerunian M, et al. MRI of the endometrium - from normal appearances to rare pathology[J]. Br J Radiol, 2021,94(1125):20201347.
宋小琳, 高素云. 微血管密度 孕激素受体与围绝经期子宫内膜息肉恶变关系分析[J]. 中国药物与临床, 2018, 18(11): 2027-2028.
Cong Q, Luo L, Fu Z, et al. Histopathology of women with non-uniform endometrial echogenicity and risk factors for atypical endometrial hyperplasia and carcinoma[J]. Am J Transl Res, 2021,13(5):4500-4509.
Romero S A, Young K, Hickey M, et al. Levonorgestrel intrauterine system for endometrial protection in women with breast cancer on adjuvant tamoxifen[J]. Cochrane Database Syst Rev, 2020,12(12);724
Shah N, Sackey N, Gopee S, et al. Cystic endometrium on ultrasound scan: Sonographic-hysteroscopic-pathologic correlation[J].Int J Gynaecol Obstet, 2021,157(3);544-548
Bernard L, Kwon J, Simpson A, et al. The levonorgestrel intrauterine system (LNG-IUS) for prevention of endometrial cancer in women with obesity is cost effective[J]. Gynecol Oncol, 2021,162(2):300-301.
Kim M K, Seong S J, Kang S B, et al. Six months response rate of combined oral medroxyprogesterone/levonorgestrel-intrauterine system for early-stage endometrial cancer in young women: a Korean Gynecologic-Oncology Group Study[J]. J Gynecolc Oncol, 2019,30(2):47
Li L, Jiang H, Wei X, et al. Bu Shen Zhu Yun Decoction Improves Endometrial Receptivity via VEGFR-2-Mediated Angiogenesis[J].Evid Based Complement Alternat Med, 2019,15(8):1-14.
Melincovici CS, Boşca AB, Şuşman S, et al. Vascular endothelial growth factor (VEGF) - key factor in normal and pathological angiogenesis[J].Rom J Morphol Embryol, 2018,59(2):455-467.
Mohamed M Z, Baky M, Hassan O A, et al. PTEN/PI3K/VEGF signaling pathway involved in the protective effect of xanthine oxidase inhibitor febuxostat against endometrial hyperplasia in rats[J]. Hum Exp Toxicol, 2020,39(2):960.
Arablou T, Aryaeian N, Khodaverdi S, et al. The effects of resveratrol on the expression of VEGF, TGF-β, and MMP-9 in endometrial stromal cells of women with endometriosis[J]. Sci Rep, 2021,11(1):6054.
Ellis P E, Barron G A, Bermano G. Adipocytokines and their relationship to endometrial cancer risk: A systematic review and meta-analysis[J]. Gynecol Oncol, 2020,158(2):507-516.
医生投稿:文章来源于医生投稿,内容仅代表作者个人观点,不代表本平台立场,转载请联系原作者。