臭氧疗法:乳腺癌治疗中的创新辅助手段
 学术前沿官方号
学术前沿官方号乳腺癌作为女性最常见的癌症形式,其治疗一直是医学研究的热点。尽管传统治疗方法取得了显著进展,但寻求更安全、更有效的辅助治疗手段仍然迫切。本文综合分析了臭氧治疗在乳腺癌治疗中的应用,探讨了其作为医疗辅助手段的潜力、作用机制、临床证据、安全性以及面临的挑战。
一、臭氧治疗的作用机制
臭氧治疗的作用机制在医学上备受关注,尤其是其免疫调节特性。臭氧通过与免疫系统的相互作用,激活免疫反应,调节细胞因子产生,并影响炎症过程。这些效应包括对巨噬细胞、T细胞、B细胞、NK细胞和树突状细胞的影响,这些细胞在治疗感染性疾病、自身免疫性疾病和癌症免疫疗法中发挥作用。在临床应用中,臭氧治疗不仅能提高白细胞活性和免疫球蛋白G水平,还能增加特定细胞因子(TNF-α)的产生,例如该治疗在人类单核细胞系模型中可增加IL-8和肿瘤坏死因子α的产生。此外,臭氧通过影响肿瘤微环境(TME)中的免疫细胞、细胞因子产生、血管生成和细胞外基质重塑,对TME产生影响,这对于癌症的启动、进展和对治疗的反应至关重要。臭氧还调节促血管生成和抗血管生成因子,影响内皮细胞,重塑细胞外基质,并调节血管生成,通过调节血管内皮生长因子(VEGF)的表达,为创伤愈合、缺血状况和组织再生提供潜在的治疗益处。因此,为了预防与改变血管通透性相关的潜在并发症,必须仔细考虑臭氧剂量和治疗持续时间。
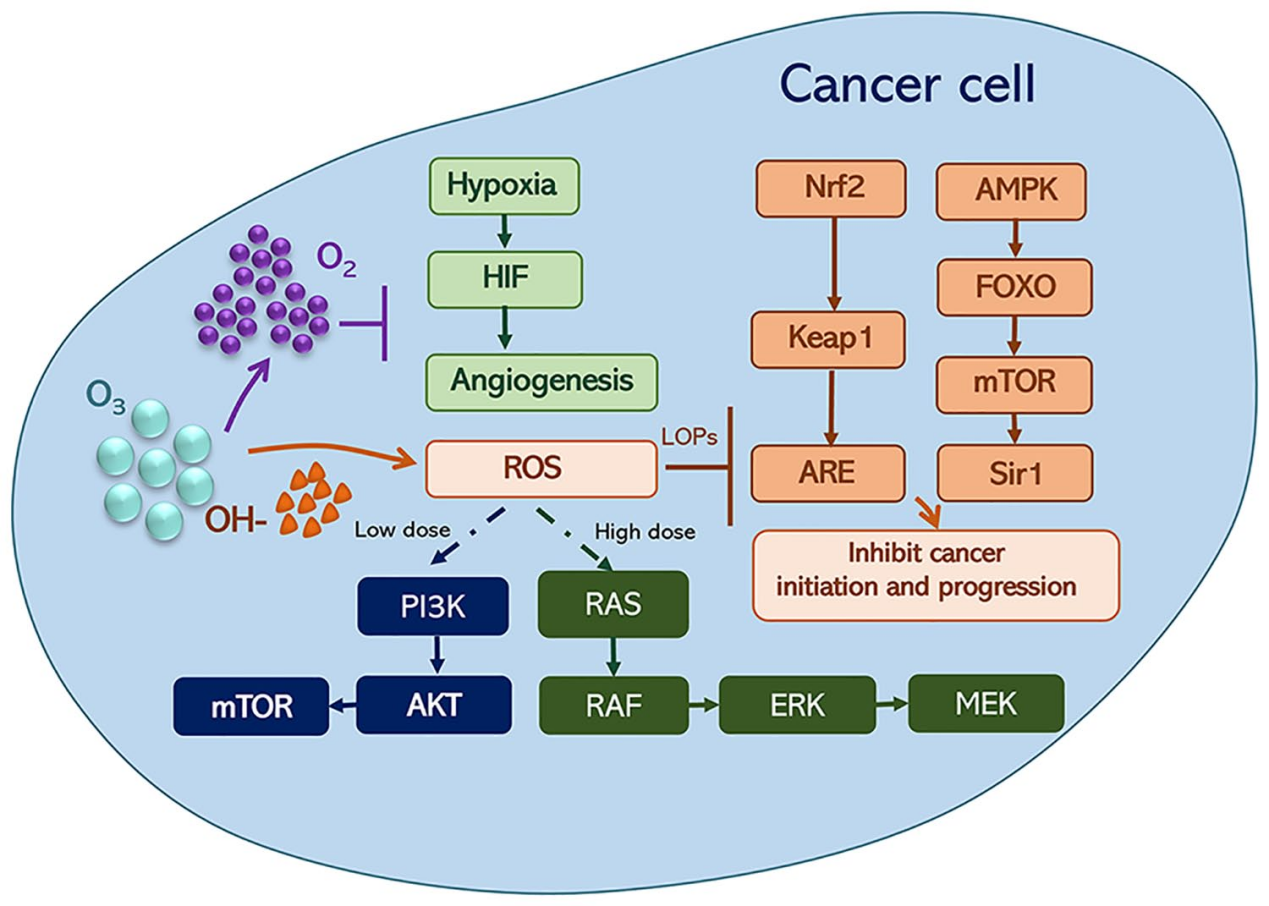
臭氧(O3)能够生成氢氧自由基(OH-)和氧气(O2),这可能通过诱导活性氧(ROS)的抗癌效应以及缓解缺氧状况来发挥抗癌效果
注:AMPK,腺苷酸激活蛋白激酶;ARE,抗氧化反应元件;ERK,细胞外信号调节激酶;FOXO,叉头蛋白O;HIF,缺氧诱导因子;Keap1,类似Kelch的ECH相关蛋白1;LOPs,脂质氧化产物;MEK,丝裂原活化蛋白激酶激酶;mTOR,哺乳动物雷帕霉素靶蛋白;Nrf2,核因子红细胞2相关因子2;PI3K,磷脂酰肌醇3激酶;RAF,快速加速的纤维肉瘤激酶;RAS,鼠肉瘤;ROS,活性氧;Sir1,酿酒酵母蛋白。
二、臭氧治疗的副作用和安全剂量
臭氧是一种强氧化剂,能够诱导细胞和组织中的氧化应激。控制的氧化应激在血管生成中发挥作用,但过量的活性氧(ROS)可能导致细胞损伤,促进氧化应激相关疾病的发展。臭氧剂量对ROS效应至关重要。低剂量下,ROS可作为细胞内信号和调节的“氧化还原信使”,并可作为“特洛伊木马”杀死癌细胞。适度水平的ROS可能促进肿瘤进展,而高水平的ROS增加癌基因活性,刺激生长因子依赖途径,引起遗传不稳定。因此,确定臭氧的安全剂量对于避免潜在并发症至关重要。在适当的剂量下,臭氧不会对正常细胞产生毒性,因为细胞的抗氧化系统通常能够处理轻微的臭氧诱导损伤。然而,高浓度的臭氧可能导致严重的副作用,包括呼吸和血管效应、过敏反应、溶血和短暂的氧化应激。
三、臭氧治疗的挑战
臭氧治疗在乳腺癌治疗中显示出潜力,但同时也面临着挑战:剂量标准化的缺乏、臭氧气体的不稳定性以及非特异性可能限制了对癌细胞的靶向能力。此外,短期接触可能导致急性呼吸道炎症,需要适当的通风和空气净化措施。臭氧可以影响血管功能和血流,因此最佳剂量和治疗持续时间应仔细考虑,以最小化氧化损伤。
四、臭氧治疗乳腺癌的临床前研究
1. 1980年Sweet等人的研究表明,臭氧在0.3至0.8 ppm的浓度下,能在8天内显著抑制人乳腺癌细胞的生长,其中0.8 ppm浓度下癌细胞生长抑制超过90%,而正常细胞仅抑制50%。
2. 1990年Zänker和Kroczek发现臭氧与化疗药物5-氟尿嘧啶(5-FU)联合使用时,对乳腺癌有协同或相加效应,并能克服5-FU的抗药性。
3. 2018年Mokhtari等人的研究表明,通过冷等离子体激活介质(PAM)产生的臭氧能有效抑制SKBR3和MCF7乳腺癌细胞系,臭氧诱导的ROS触发了JNK和p38激酶途径,促进线粒体紊乱。2022年Karagülle和Yurttas发现,阿霉素与臭氧联合使用能增强对MCF-7细胞(luminal-A型)的抗癌效果,通过激活TNF-α、MMP-2和MMP-9的表达。
4. 2022年Yıldırım等人的研究表明,臭氧气体能抑制乳腺癌增殖。
5. 2023年Karagülle和Yurttas再次发现,阿霉素与臭氧联合使用对BT-474细胞(luminal-B型)同样有效。这些发现为臭氧治疗作为乳腺癌潜在的辅助治疗手段提供了科学依据,提示其可能通过调节肿瘤微环境和增强免疫反应来抑制癌细胞生长和化疗抗性。
五、臭氧治疗乳腺癌的临床研究
1. 2001年Kontorshchikova等人研究中,32名乳腺癌患者接受了臭氧治疗,包括静脉输注、直肠充气和臭氧水治疗。结果显示臭氧治疗能减少化疗引起的毒性,改善生活质量,并显著增强抗氧化防御系统的活性。
2. 2011年 Clavo等人报道了一例乳腺癌患者,该患者有持续的PORT-A-CATH®相关的瘘管和纤维化问题,通过局部应用臭氧/氧气混合气体(100 μg/mL),症状显著改善。
3. 2012年Alekberov和Potanin研究表明,151名接受乳房重建手术的乳腺癌患者中,71名接受了臭氧治疗。治疗后,组织中的氧气张力和血液流动正常化,术后早期并发症的频率降低。
4. 2013年Waked等人进行了一项随机临床试验,研究臭氧治疗对乳腺癌相关淋巴水肿(BCRL)的效果。结果表明,臭氧治疗结合物理疗法能更有效地减少BCRL患者肢体的体积和厚度。
5. 2018年Tirelli等人的研究中,15名乳腺癌患者接受了臭氧自血回输治疗,以减轻疲劳症状。73%的患者疲劳程度显著降低,且未出现显著副作用。
这些研究表明,臭氧治疗作为乳腺癌的辅助治疗手段,能够改善患者的生活质量,减少化疗引起的副作用,并可能对淋巴水肿和疲劳等症状有积极效果。然而,需要更多的临床试验来进一步阐明臭氧治疗的抗癌效果。
六、讨论
我们发现,迄今为止发表的9项前临床研究表明,臭氧单独或与化疗联合使用是抑制乳腺癌生长的有效方法。然而,臭氧治疗的剂量依赖性效应以及在不同浓度下的不同效应表明,并非所有肿瘤对臭氧同样敏感。
结论
臭氧治疗是乳腺癌治疗中一个有前景的辅助治疗选项。随着肿瘤学领域的发展,将臭氧治疗与传统癌症治疗相结合,可能会改善乳腺癌患者的治疗结果。研究人员、临床医生和监管机构之间的协作努力是推进基于证据的臭氧治疗与传统治疗在乳腺癌管理中整合的必要条件。
参考文献
【1】Li Y, Pu R. Ozone Therapy for Breast Cancer: An Integrative Literature Review. Integr Cancer Ther. 2024 Jan-Dec;23:15347354241226667. doi: 10.1177/15347354241226667.
原创文章:方舟健客版权所有,未经许可不得转载。








