Th17不是源头,银屑病到底从哪一步开始失控?Nature揭秘浙大二院团队发现的这个表皮炎症新起点
 学术前沿官方号
学术前沿官方号银屑病是一种常见的慢性免疫介导性炎症性皮肤病,全球患病率约2%-3%左右,我国也有相当数量的患者,需要长期面对反复发作的红斑、脱屑和瘙痒,严重者还会累及关节和多系统[1]。大量研究已经证明,白细胞介素-23/白细胞介素-17(IL-23/IL-17)轴是银屑病发病的主通路,相关的生物制剂已经在临床广泛应用[2]。
不过,到底是谁在皮肤局部“点火”?哪些细胞先动起来?角质细胞只是被动“受害者”,还是也在主动推波助澜?这些问题一直没有完全回答。
近期,浙江大学医学院附属第二医院皮肤科团队在Nature Communications发表了一篇标题为“Single cell transcriptomics of human psoriasis and epidermal specific Ube2l3 deficient mice highlight CXCL16/CXCR6 involvement in psoriasis development”的研究[3]。该研究不仅构建了一种新型表皮特异性Ube2l3缺陷小鼠模型,还首次系统性地揭示了CXCL16/CXCR6信号轴在银屑病表皮免疫微环境中的核心作用,为未来精准治疗提供了新靶点。

一、传统认识:IL-23/IL-17轴是“主干线”,但发源并不清晰
过去十多年,银屑病发病模型大致可以概括为:外界触发因素(感染、机械刺激、药物、压力等)作用于皮肤,引起角质细胞损伤和应激,释放抗菌肽和危险信号;这些信号激活树突状细胞(DC),促使其产生IL-23等细胞因子,继而驱动T细胞向Th17/Tc17方向分化,源源不断分IL-17A、IL-17F等炎症因子,再次作用于角质细胞,引起表皮增生、炎症细胞浸润和血管扩张[4]。
IL-23/IL-17轴的重要性已经被大量临床实践印证,以司库奇尤单抗、依奇珠单抗、比美木单抗等为代表的IL-17及其受体抑制剂,和针对IL-23的多种单抗,已成为中重度银屑病治疗的核心药物[5]。
另一方面,有研究早就注意到C-X-C基序趋化因子16(CXCL16)及其受体C-X-C趋化因子受体6(CXCR6)在银屑病皮损中明显上调:CXCL16主要由角质细胞、单核细胞和树突状细胞表达,而CXCR6更多表达在CD8⁺ T细胞上,功能实验提示CXCL16能选择性招募CXCR6⁺ CD8⁺ T细胞进入皮肤,并促进其迁移和活化[6]。
但这些工作往往聚焦单一细胞或单一环节,没有把角质细胞、树突状细胞、γδT细胞和CD8⁺ T 细胞放在同一幅“细胞地图”中系统分析。这一空白,正是本次中国研究团队补齐的。
二、中国团队构建新型银屑病小鼠模型,模拟人体病理特征[3]
研究起点来自一个关键分子:泛素结合酶E2L3(UBE2L3)。团队此前的研究提示,银屑病患者表皮中UBE2L3表达下调,与前体白细胞介素-1β(pro-IL-1β)的降解障碍有关,从而导致IL-1β在表皮局部堆积。
为了进一步验证UBE2L3在银屑病中的作用,浙大团队构建了表皮特异性Ube2l3基因敲除小鼠(Ube2l3△Epi),通过他莫昔芬诱导,成功模拟了人类银屑病的典型表现:皮肤增厚、红斑、鳞屑,以及表皮增厚、血管新生、T细胞浸润等组织学特征。
更重要的是,该模型在转录组和蛋白水平与人类银屑病高度相似。通过批量RNA测序和单细胞RNA测序,研究者发现,在表皮中显著上调的基因主要富集在IL-17信号通路、炎症反应、细胞趋化等关键通路中,而在真皮中的变化则相对有限,提示表皮是银屑病免疫反应的主战场。
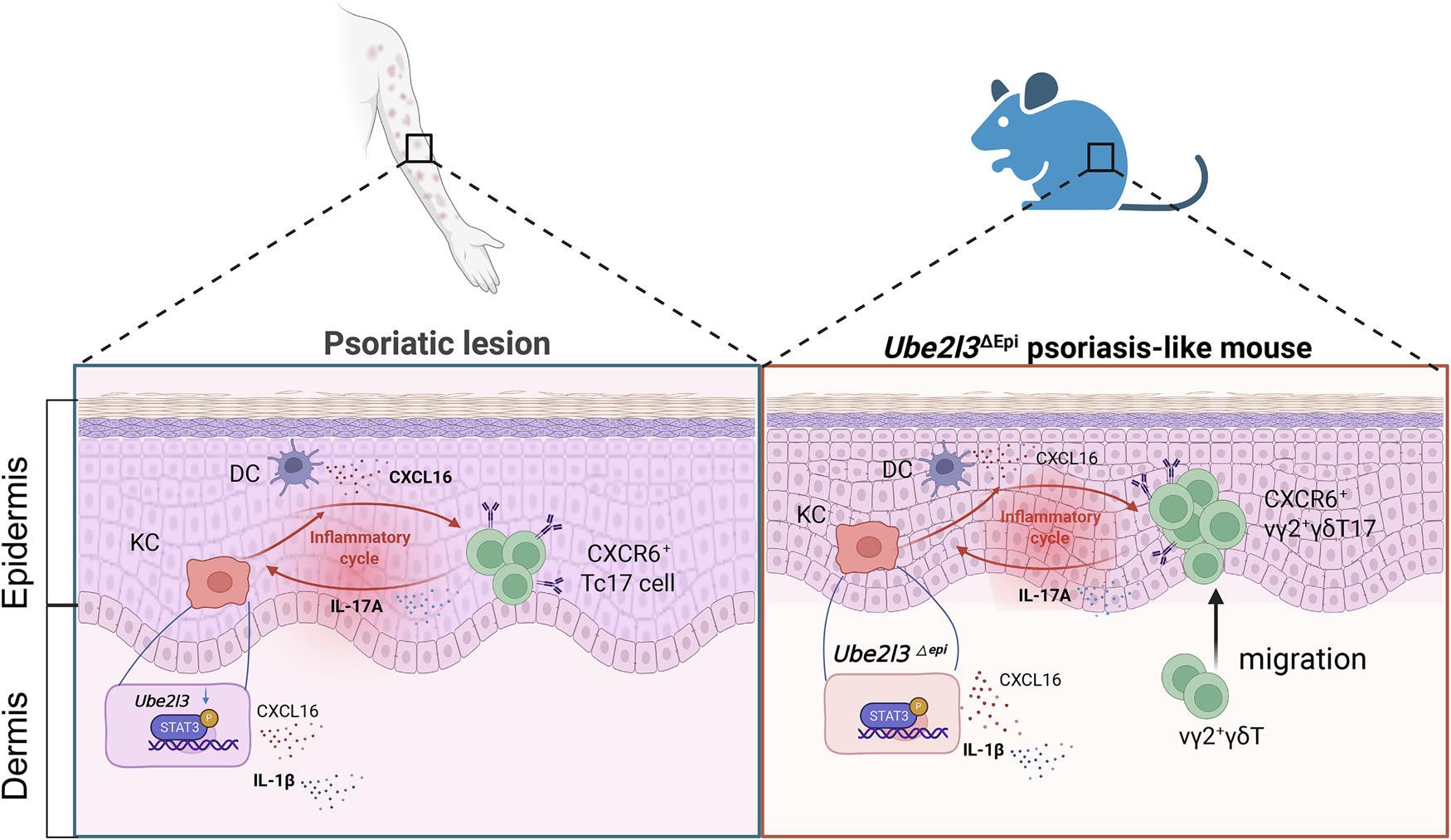
图1 摘要图示[3]
三、谁在分泌IL-17A?小鼠与人之间存在“物种差异” [3]
有了可靠的小鼠模型,团队进一步利用单细胞 RNA 测序(scRNA-seq)对表皮浸润的淋巴细胞进行精细分型,重点寻找 IL-17A究竟来自哪一群细胞。
1. 小鼠:表皮的 IL-17A 主要来自 Vγ2⁺ γδT17
在 Ube2l3^ΔEpi 小鼠表皮中,scRNA-seq显示一类γδT17 细胞(gdT17)显著增多,它们高表达 Il17a、Il17f 以及特征性TCR基因(Tcrg-V4 等),而传统的树突状表皮 T 细胞(DETC)比例下降。
流式细胞术进一步证实,在Ube2l3^ΔEpi小鼠表皮中,IL-17A⁺ γδT细胞比例显著高于对照小鼠,而αβT细胞中的IL-17A变化并不明显;真皮中γδT细胞的IL-17A表达则无明显差别。中和 IL-17A 的抗体处理,可以明显减轻表皮增厚、降低T细胞浸润、促进角质细胞分化。
这说明,在小鼠表皮 Ube2l3 缺失的背景下,Vγ2⁺ γδT17 是表皮IL-17A的主要来源和关键致病细胞。
2. 人类:银屑病表皮的主角是CXCR6⁺ CD8⁺ Tc17
在另一端,研究者对人类银屑病皮损和正常表皮的T细胞进行了单细胞测序和整合分析,分析结果显示:在银屑病表皮中,以Tc17为代表的CD8⁺ T细胞亚群明显富集,且表达IL-17A、IL-17F、IL-26、CCL20等多种17型细胞因子;一个非常突出的特征,是这些Tc17亚群上CXCR6 表达显著升高;免疫荧光可以看到CXCR6⁺ CD8⁺ T细胞大量聚集于银屑病表皮。
流式细胞术则证实,银屑病表皮中IL-17A⁺CXCR6⁺ T细胞比例显著增加,其中以CD8⁺ T细胞为主。
也就是说,在人类银屑病中,IL-17A的主要“源头”是CXCR6⁺ CD8⁺ Tc17细胞,而不是传统意义上我们熟悉的Th17细胞。
尽管细胞类型存在差异,但两者在信号通路层面高度一致,均高表达CXCR6受体,且其配体CXCL16在表皮中显著上升。这表明,CXCL16/CXCR6信号轴在银屑病的IL-17A产生中具有跨物种的保守性。
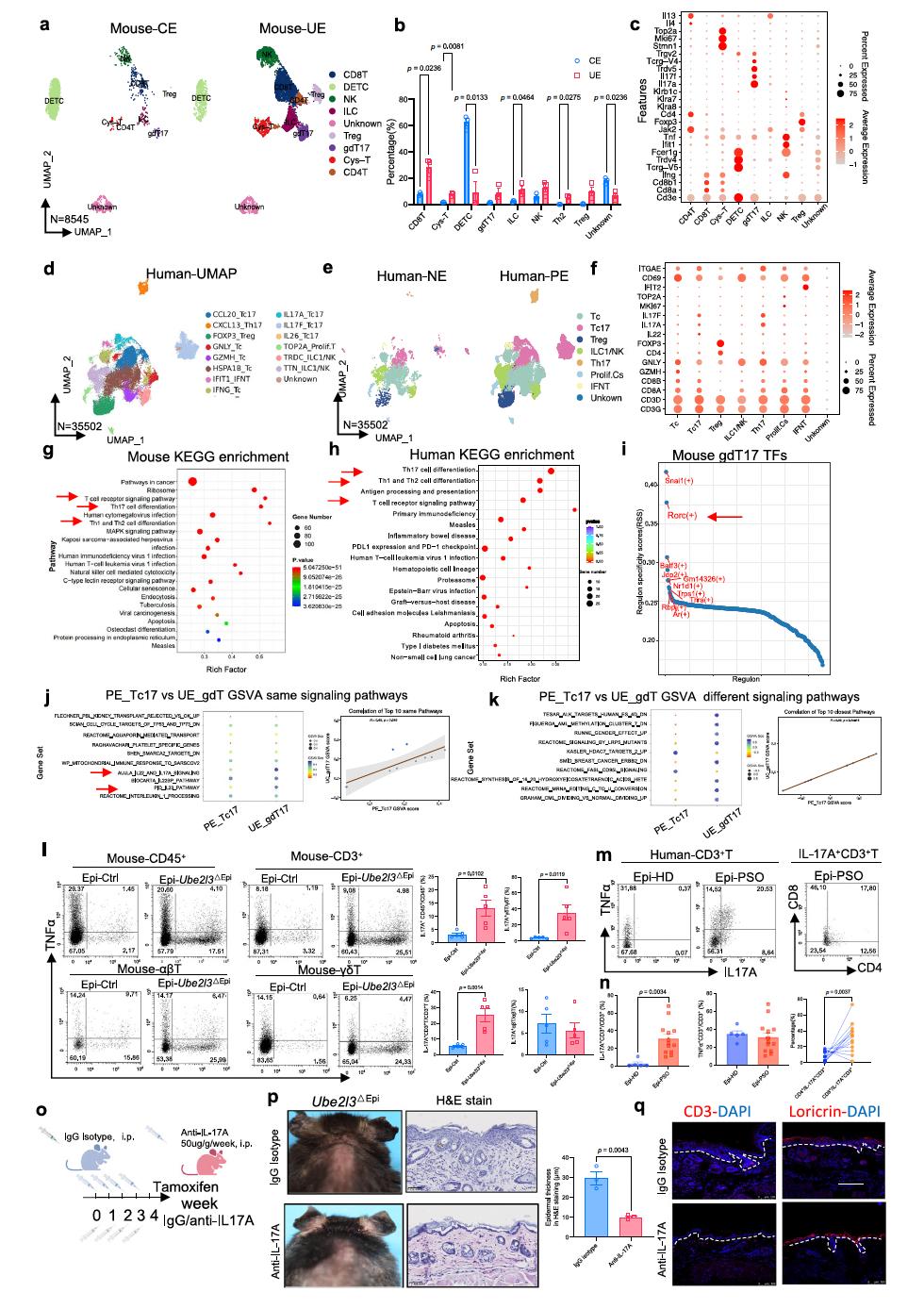
图2 小鼠与人类表皮中CD8⁺ Tc17与γδT17淋巴细胞亚群的对比分析[3]
四、CXCL16/CXCR6:银屑病表皮中的“通讯热线” [3]
为了验证这一假设,研究者通过细胞间通讯分析 发现,在Ube2l3缺陷小鼠的表皮中,角质形成细胞和树突状细胞高表达CXCL16,而γδT细胞(小鼠)或CD8+ T细胞(人) 则高表达其受体CXCR6。这条“配体-受体对”成为表皮免疫细胞之间最活跃的通讯通道之一。
进一步实验表明,Ube2l3缺失会导致角质形成细胞中IL-1β积累,进而通过STAT3信号通路上调CXCL16的表达。而CXCL16则会吸引更多CXCR6+ T细胞进入表皮,分泌IL-17A,形成正反馈环路,持续放大炎症反应。
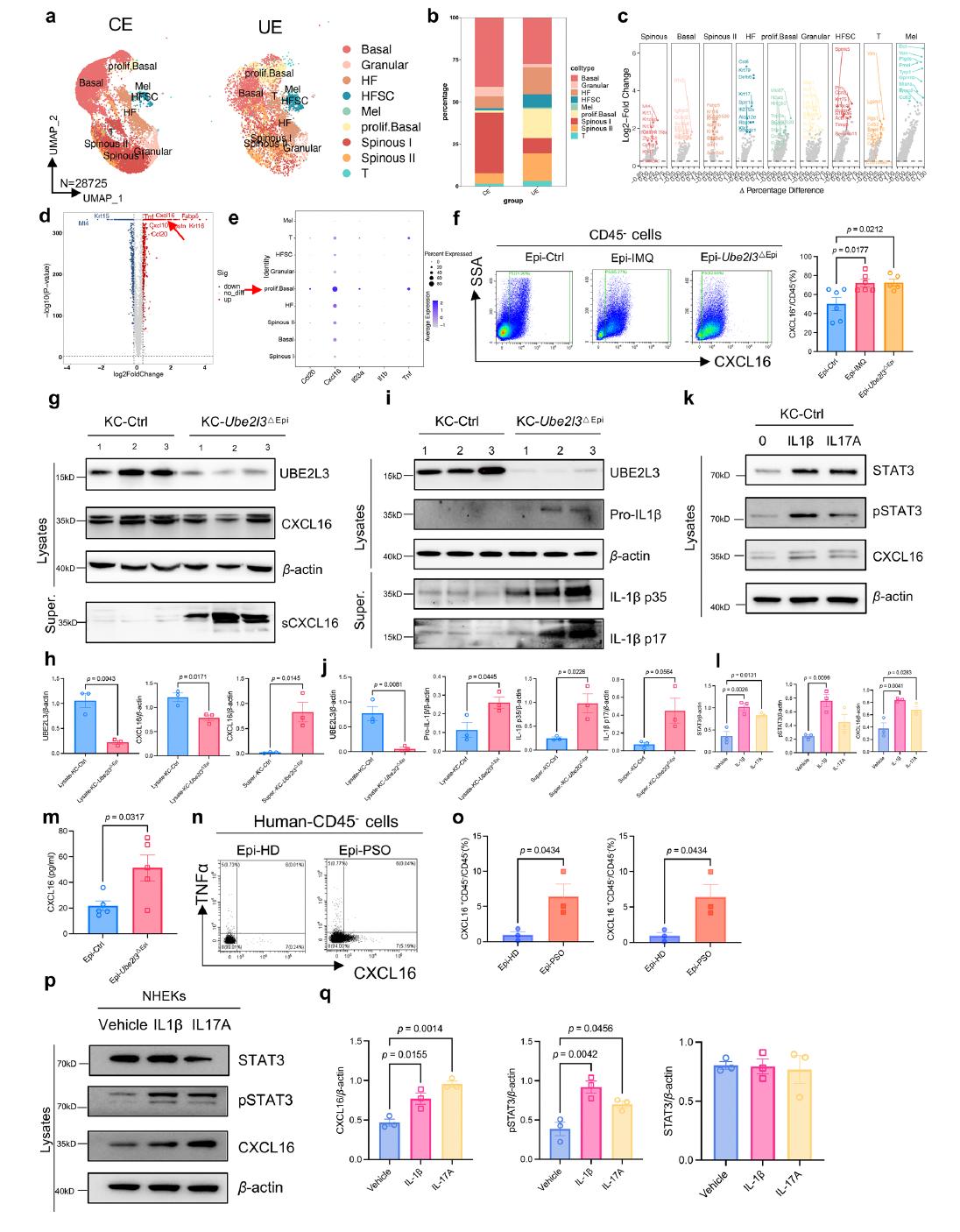
图3 小鼠CXCR6⁺Vγ2⁺ γδT与人类CXCR6⁺CD8⁺ T细胞在银屑病中主导IL-17信号[3]
五、干预CXCL16:小鼠模型中显示治疗潜力[3]
在机制明确的基础上,研究者尝试了CXCL16中和抗体治疗。结果显示,在Ube2l3缺陷小鼠中,阻断CXCL16能显著减轻皮肤病变、降低表皮厚度、减少IL-17A+ T细胞浸润。同样,在人类银屑病表皮中,外源性CXCL16也能促进CD8+ T细胞分泌IL-17A。
这些结果提示,CXCL16不仅是一个生物标志物,更是一个潜在的治疗靶点。
总 结
这篇来自中国团队的研究,用单细胞多组学和表皮特异性基因工程小鼠,给我们呈现了一条更加完整的银屑病表皮免疫通路:
1. 在结构上,他们构建了一个高度接近人类银屑病的 表皮Ube2l3缺失小鼠模型,并通过跨物种转录组对比证明,两者在表皮免疫网络高度相似;
2. 在细胞层面,他们揭示了 小鼠以Vγ2⁺ γδT17、人类以CXCR6⁺ Tc17为主要IL-17A来源,并通过 CXCL16/CXCR6 把这些细胞与角质细胞、树突状细胞连接起来;
3. 在分子机制上,他们把UBE2L3-IL-1β-STAT3与CXCL16-CXCR6-IL-17串成一条闭合的正反馈环,将角质细胞明确放在炎症“起点”位置。
对于临床和科研工作者来说,这不仅是一次机制上的细致补充,也为未来围绕CXCL16/CXCR6、表皮免疫稳态以及复发性银屑病的精准干预提供了新的想象空间。
参考文献:
1. Yao Y, Chen LQ, et al. Skin immune microenvironment in psoriasis: from bench to bedside. Front Immunol. 2025;16:1643418.
2. Menter A, Krueger GG, et al. Interleukin-17 and Interleukin-23: A Narrative Review of Mechanisms of Action in Psoriasis and Associated Comorbidities. Dermatol Ther (Heidelb). 2021;11(2):385-400.
3. Chen XY, Ye LR, et al. Single cell transcriptomics of human psoriasis and epidermal specific Ube2l3 deficient mice highlight CXCL16/CXCR6 involvement in psoriasis development. Nat Commun. 2025;16(1):9084. Published 2025 Oct 13.
4. Lowes MA, Russell CB, Martin DA, Towne JE, Krueger JG. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses. Trends Immunol. 2013;34(4):174-181.
5. AlMutairi N, Eassa BI. Comparing the efficacy and safety of IL-17 inhibitors for treatment of moderate-to-severe psoriasis: a randomized double blind pilot study with a review of literature. Postepy Dermatol Alergol. 2021;38(2):281-288.
6. Steffen S, Abraham S, Herbig M, et al. Toll-Like Receptor-Mediated Upregulation of CXCL16 in Psoriasis Orchestrates Neutrophil Activation. J Invest Dermatol. 2018;138(2):344-354.
原创文章:方舟健客版权所有,未经许可不得转载。








