让冷肿瘤「燃」起来!约翰霍普金斯最新研究用这2条信号通路重塑持久抗癌记忆
 学术前沿官方号
学术前沿官方号“免疫热肿瘤”是指肿瘤微环境中存在丰富的免疫细胞(如CD8+T细胞、活化NK细胞等),表现为炎症性、免疫活跃,通常对免疫检查点抑制剂(immune checkpoint inhibitors, ICI)等免疫治疗反应良好[1]。相对地,“免疫冷肿瘤”则几乎没有有效的免疫细胞浸润,免疫原性低、免疫抑制机制强,因此对免疫治疗反应差、预后不佳。

冷/热肿瘤的肿瘤免疫表型分类[2]
(在图中,冷肿瘤精细划分为三种表型:免疫荒漠型(T细胞完全缺失)、免疫排斥型(T细胞被基质物理阻隔)及免疫抑制型(T细胞功能耗竭且被抑制性细胞/因子包围),它们共享低突变负荷、抗原提呈缺陷等特征,导致免疫治疗耐药。与之相对,热肿瘤则以细胞毒性T细胞高度浸润、存在维持免疫活化的三级淋巴结构及促炎微环境为标志,对免疫检查点抑制剂等治疗反应良好。)
如何将冷肿瘤微环境转化为热肿瘤状态,已成为肿瘤免疫学研究的核心议题。好在现有多种策略正试图打破这一困局:
其一是诱导免疫原性细胞死亡(ICD),通过化疗、放疗或光动力疗法促使肿瘤细胞释放损伤相关分子模式(DAMPs),从而激活树突状细胞、促进抗原呈递与效应性T细胞浸润[3]。
其二是激活cGAS–STING通路,利用小分子激动剂或纳米材料(如金属有机框架系统)刺激先天免疫感应器,促进I型干扰素分泌与免疫细胞募集,重塑免疫抑制性微环境[4]。
其三是联合ICI与多种免疫调节策略,如与肿瘤疫苗、溶瘤病毒、CAR-T细胞治疗或肠道微生物组调节结合,以提升抗原呈递效率、解除免疫抑制、促进效应T细胞功能恢复[5]。
这些策略虽已在多种肿瘤模型中显示出一定潜力,但要真正“点燃”冷肿瘤、建立持久免疫记忆,仍需从肿瘤局部的免疫结构重建入手,即让肿瘤自身具备像淋巴结一样的免疫反应能力。
近期,来自约翰霍普金斯医学院的研究团队在Nature Immunology发表的重要成果,为这一目标提供了突破性思路:他们提出通过同时激活STING通路与淋巴毒素-β受体(LTβR),在原本冷肿瘤中诱导形成类似淋巴结的三级淋巴结构(TLS),从而构建热肿瘤的内部基础设施[6]。这一策略不仅显著增强了T细胞与B细胞的协同免疫反应,更在动物模型中建立了长期、可防复发的抗肿瘤记忆。

以下,我们将逐步解读这项工作如何在冷肿瘤中点燃免疫、建造淋巴结构、留存免疫记忆,并探讨其在临床转化中的深远意义。
研究设计与验证逻辑
首先,TLS是在慢性炎症组织中形成的异位淋巴聚集体,结构与淋巴结中的次级淋巴滤泡相似。它由B细胞密集簇、滤泡辅助T细胞(Tfh)、滤泡树突细胞等构成,周围环绕着CD4+与CD8+T细胞,并常伴随高内皮微静脉(HEVs)——一种通常在淋巴结中存在的特殊血管,负责招募循环中的初始淋巴细胞进入组织。
临床研究表明,TLS的存在与多种癌症(如乳腺癌、肺癌、胰腺癌、肉瘤等)患者的良好预后密切相关。它不仅是一个“免疫细胞聚集地”,更是一个功能活跃的免疫反应中心,支持B细胞的激活、抗体类别转换、记忆细胞形成,甚至局部产生高亲和力抗体。
研究人员从对TLS丰富与TLS缺乏肿瘤血管/微环境的转录组差异入手,识别出与TLS形成相关的信号通路(包括type-I IFN、TNF、TLR、LTβ等)与B/T细胞募集与生发中心形成相关的因子(如CXCL13、IL-21等)。基于此“反向工程”理念,作者用药物/抗体尝试在TLS-缺乏的小鼠肿瘤中复刻 TLS丰富肿瘤的微环境。
实验框架简要如下:使用三类小鼠肿瘤模型(KPC胰腺癌皮下移植、Py230乳腺原位模型与 76-9肌肉内横纹肌瘤模型),在肿瘤达一定体积时给予单次局部STING激动剂并配合系统性抗-LTβR激动抗体,并在14天后取材或在某些实验中行肿瘤切除并进行复种/复发观察。
形态学与时序证据:能否“长出”TLS 和 HEV?
最直观的问题是:单纯刺激STING或LTβR能否在TLS-缺乏肿瘤中诱导成熟的TLS?研究人员通过免疫组织化学与免疫荧光展示发现:
LTβR单药或LTβR+STING联合均能在多种模型中诱导出密集的B细胞簇并伴随MECA-79 阳性的高内皮微静脉(HEV)形成;而单用 STING(ADU-S100)很少形成B细胞富集的TLS(即STING单药只能产生不含成熟B细胞的淋巴小簇)。所有接受LTβR(单药或联合)的小鼠都出现 TLS,但联合组在“质量”上更胜一筹(更成熟的生发中心标记与细胞互动)。
三维共聚焦成像显示,组合治疗的肿瘤内TLS具有Bcl6阳性的生发中心样B细胞、TFH(CD4+)细胞嵌入其间、以及大量Ki-67阳性增殖的B细胞,组织形态接近人类癌症中被认为“成熟”的 TLS。
因此,诱导TLS不仅是增加淋巴细胞数量,更要形成带HEV的组织学结构与生发中心样微环境,这涉及微血管/化学趋化因子的改造,单一刺激往往不足。

图1:药物诱导皮下肿瘤中TLS及HEV的形成[6]
TLS 的产生是谁在“操刀”?
通过使用免疫缺陷小鼠(裸鼠)、以及体内选择性耗竭 CD4+、CD8+ T细胞或使用B细胞缺陷(CD79a KO)小鼠,研究表明 TLS 的形成是一个多细胞协同过程:
在T细胞缺失的裸鼠中,组合治疗无法形成TLS或HEV,肿瘤B细胞浸润极少,提示T细胞对构建肿瘤TLS至关重要。
在去除CD4或CD8的条件下,任一亚群的缺失都会显著抑制TLS形成;有趣的是CD8+ 耗竭对HEV形成影响尤大,而CD4+耗竭对HEV影响较小但仍会阻断TLS的成熟,说明不同 T 细胞亚群在“门(HEV)”与“工厂(TLS)”构建上扮演不同角色。
B细胞缺失会阻止TLS的出现,但HEV在缺B的小鼠中仍可有限度形成,提示B细胞也参与维持HEV密度。
TLS是否“工作”?
形态学的 TLS 若不能开展生发中心功能,其临床意义有限。研究在这一点上给出了强烈证据:
• 联合治疗诱导的TLS内出现Bcl6+(生发中心转录因子)、CD138+IgG+的浆细胞簇,且细胞显示活化标记(CD69、CD44);流式证明肿瘤浸润淋巴细胞中B细胞占比显著升高,并伴随CD73+PD-L2+ 表型的记忆B细胞增加。
• 组织转录组与单细胞转录组显示:组合组肿瘤显著上调IL-21/IL-21R、CXCR5、CD40/CD40LG、TNF、IFNG等支持TFH-B轴与生发中心活动的基因,并伴随免疫原性IgG重链转录本的累积,提示实际有抗体产生并偏向于IgG(而非 IgA)。
• 在骨髓中检测到Blimp1+与 CD138+长寿命浆细胞的增加,血浆中也能检测到对肿瘤细胞结合的IgG;此外,将经组合治疗并切除原发肿瘤的供体血清转入处理-未接触肿瘤的小鼠,可部分复制抗肿瘤效应,证明了体液免疫在免疫记忆与抑瘤中发挥作用。
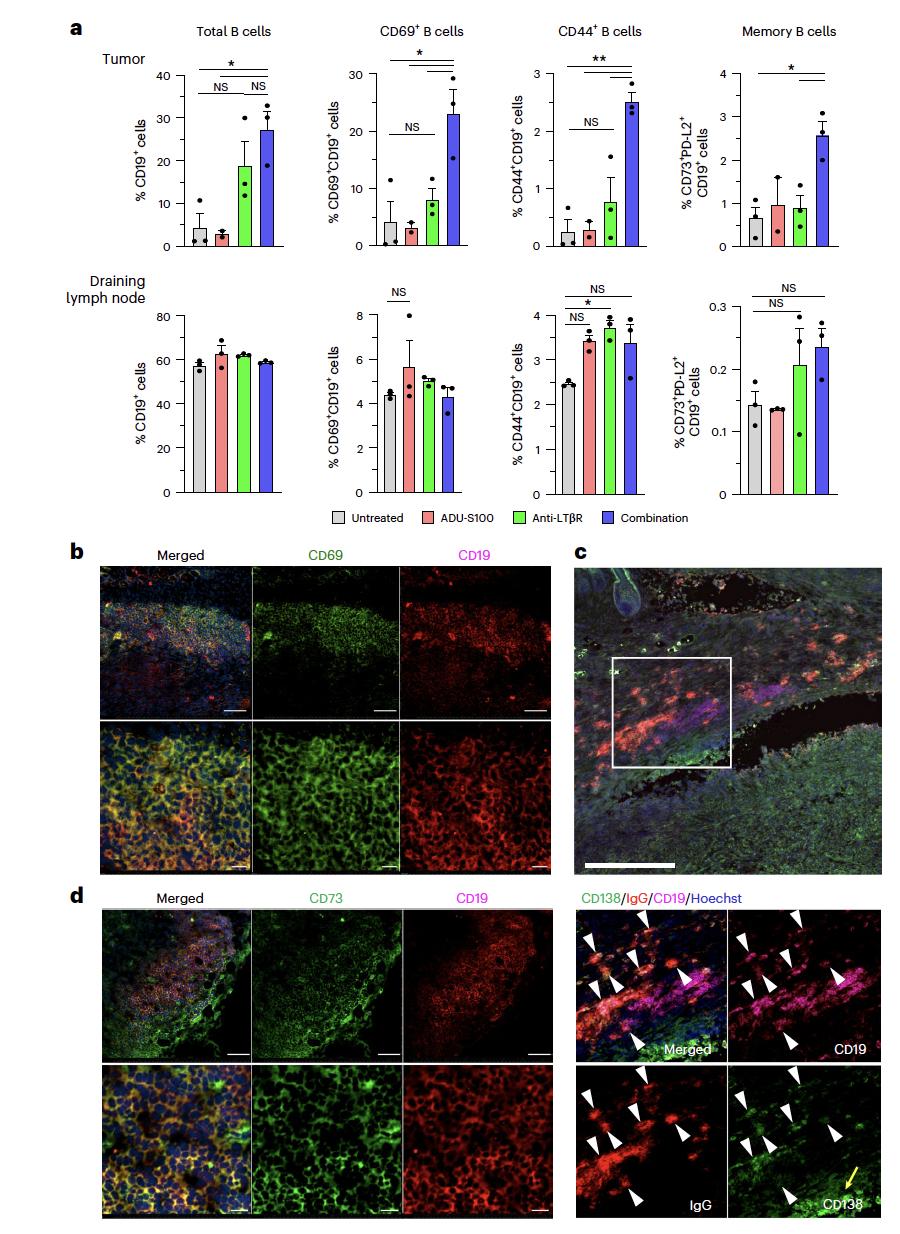 图2:药物诱导的TLS中存在经抗原激活并完成类别转换的浆细胞及记忆B细胞[6]
图2:药物诱导的TLS中存在经抗原激活并完成类别转换的浆细胞及记忆B细胞[6]
短期的细胞毒性与长期的体液协同——疗效与抗复发模型
研究人员在肿瘤生长与手术后复发模型中给出了时间维度的功能证据:
• 在短期观察期内,联合治疗对KPC、Py230与76-9肿瘤均显著延缓生长,抑瘤作用在T细胞缺失小鼠中消失,提示早期效应主要依赖CD8+ T细胞的细胞毒性活动。
• 在新辅助设定下:先给予组合激动剂并在切除肿瘤与哨点淋巴结,随后2–3周复种肿瘤细胞用于模拟复发。结果显示:经联合新辅助处理并形成TLS的鼠群对再接种肿瘤呈现强烈免疫抵抗(长期存活/肿瘤回退),而STING单药几乎无此长期保护,LTβR单药有中等的保护但不如联合组持久。
进一步的机能学去除实验显示:在已经接受新辅助组合治疗的供体中,后续去除CD8或NK 细胞会丧失对复种肿瘤的抑制;在B细胞缺陷小鼠中,组合新辅助无法完全阻止复发,提示长期抑瘤是细胞免疫(CD8+、NK)与体液/记忆B细胞协同作用的结果。
总 结
约翰霍普金斯团队的这项工作提出并验证了一个清晰且逻辑自洽的概念:通过同时激活先天的STING路径与淋巴器官发生相关的LTβR路径,能够在原本冷免疫肿瘤中诱导结构上成熟且功能上活跃的TLS,使肿瘤成为“就地免疫工厂”——既有早期CD8+ T细胞介导的抗肿瘤效应,也能生成长期存在的IgG-产生长寿命浆细胞与记忆B/T,从而在新辅助情境下对复发提供持久保护。
对于临床与转化研究领域,这项研究不仅提供了一条“从门(HEV)到工厂(TLS)再到系统记忆(骨髓浆细胞/血清IgG)”的完整技术路线,也提醒了两点:一是免疫微环境的改造必须同时兼顾结构和功能;二是任何针对TLS的诱导策略均须重视长期安全性与抗原特异性鉴定。
参考文献:
1. Sang M, Ge J, et al. Immune regulatory genes impact the hot/cold tumor microenvironment, affecting cancer treatment and patient outcomes. Front Immunol. 2025;15:1382842. Published 2025 Jan 22.
2. Liu YT, Wang YL, et al. Turning cold tumors into hot tumors to ignite immunotherapy. Mol Cancer. 2025 Oct 14;24(1):254.
3. Han Y, Tian X, Zhai J, Zhang Z. Clinical application of immunogenic cell death inducers in cancer immunotherapy: turning cold tumors hot. Front Cell Dev Biol. 2024;12:1363121. Published 2024 May 7.
4. Xu M, Chang Y, Zhu G, Zhu X, Song X, Li J. Transforming Cold Tumors into Hot Ones with a Metal-Organic Framework-Based Biomimetic Nanosystem for Enhanced Immunotherapy. ACS Appl Mater Interfaces. 2023;15(14):17470-17484.
5. Khosravi GR, Mostafavi S, et al. Immunologic tumor microenvironment modulators for turning cold tumors hot. Cancer Commun (Lond). 2024;44(5):521-553.
6. Sawada J, Kikuchi Y, et al. Simultaneous STING and lymphotoxin-β receptor activation induces B cell responses in tertiary lymphoid structures to potentiate antitumor immunity. Nat Immunol. 2025;26(10):1766-1780.
原创文章:方舟健客版权所有,未经许可不得转载。









