心力衰竭与慢性肾脏病:共病状态下的治疗策略
 学术前沿官方号
学术前沿官方号心力衰竭(HF)是医疗保健领域的一大难题,常与肾功能下降共存。心脏与肾脏之间的病理生理关系是双向的,共同的机制导致这些器官功能障碍,形成心肾恶化的恶性循环。此外,肾功能恶化对HF患者的预后有不可否认的负面影响,因此寻找新的治疗策略和生物标志物的鉴定是必要的。本综述聚焦于心力衰竭患者中慢性肾脏病(CKD)的病理机制和治疗策略。
心力衰竭(HF)是由心脏损伤和心脏过载引起的异质性临床综合征,导致心腔内压升高和心输出量不足。根据左心室射血分数(LVEF),HF分为三类:射血分数保留(HFpEF;LVEF≥50%)、轻度降低(HFmrEF;LVEF 41–49%)和降低(HFrEF;LVEF≤40%)。然而,右心室功能障碍也可能导致HF。HF患者存在多种共病,与更高的死亡风险、医疗成本增加和不良预后密切相关。心脏和肾脏在维持盐-水稳态和正常血压中发挥着密切作用。肾脏功能不全和盐和水排泄障碍导致心脏前负荷和后负荷增加。此外,心输出量降低可减少肾脏灌注,导致肾衰竭。因此,肾脏功能不全是HF最严重的后果之一。
心力衰竭过程中慢性肾脏病的病理机制
2.1心脏和肾脏之间的双向相互作用
心脏和肾脏在维持体内液体稳态和正常血压中发挥重要作用。在生理条件下,心脏和肾脏之间的合作能够响应肾脏灌注的变化,如容量减少或超负荷,这可能导致缺血或过灌注损伤。另一方面,一个器官的突然恶化或慢性衰竭可能与另一个器官功能的降低有关。肾脏排盐和排水能力的丧失、肾素分泌不当以及心肌病变因素,如心肌梗死、左心室肥厚和纤维化,增加心脏的前负荷和后负荷,导致持续的容量和压力过载。这些异常的长期存在可能导致心力衰竭或加剧已有的HF。通过血管床的共同连接、交感神经系统(SNS)和肾素-血管紧张素-醛固酮系统(RAAS)的调节,对肾小管造成压力。由于心输出量低导致的肾脏灌注不足,以及由右心衰竭引起的肾脏静脉充血,导致肾衰竭。此外,共同的额外风险因素,包括糖尿病、肥胖、贫血和铁缺乏或盐紊乱,影响CKD中HF的发生,反之亦然。共同的病理机制、共享的风险因素或系统性疾病可能影响心脏和肾脏,导致它们的同时功能障碍。

心力衰竭与慢性肾脏疾病的关系
RAAS,肾素-血管紧张素-醛固酮系统;SNS,交感神经系统
2.2神经激素变化
在慢性心力衰竭过程中,器官低血压和低灌注导致补偿机制的激活,特别是肾素-血管紧张素-醛固酮系统的激活和交感系统的激活。作为RAAS激活的结果,血管紧张素II(AII)刺激交感神经系统,该系统支配肾小球的入球和出球小动脉。交感神经系统的激活导致这两种血管收缩,肾血流量和GFR降低。AII对心血管系统的直接作用是增加心脏的前负荷和后负荷(通过肾脏中钠和水的保留增加),导致心肌氧需求增加。AII还提高了精氨酸加压素(AVP)的水平,这有助于CKD的进展。
2.3炎症
由慢性心衰(CHF)引起的低血压和器官低灌注导致由ATII刺激的AVP和内皮素(EI)的增加。EI是一种促炎性、促纤维化和血管收缩蛋白。它刺激转化生长因子β(TGF-β)和核转录因子κB(NF-κB),在肾脏中维持炎症。此外,醛固酮刺激纤维连接蛋白的产生,导致肾小球中纤维化过程的加剧。
2.4氧化应激
在CHF中,持续的低灌注和缺氧加剧了肾脏的氧化应激。此外,由AII激活的氧化物酶,还原型烟酰胺腺嘌呤二核苷酸(NADH)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)导致活性氧(ROS)的产生,与受损的抗氧化屏障一起也引起氧化应激。
2.5尿毒症毒素
通过肾脏排泄丧失而保留的尿毒症毒素被描述为促进心脏重构和肾脏损害的因素,但它们确切的作用尚不清楚。尿毒症毒素从CKD的早期阶段开始积累。
2.6贫血
近年来,研究人员将贫血视为心力衰竭和慢性肾脏病病理生理和进展的一个关键因素。贫血的发病率随着CKD和HF的恶化而增加。
治疗
3.1肾素-血管紧张素-醛固酮系统抑制剂
在心力衰竭治疗中扮演着核心角色,主要通过调节血压和维持体内水电解质平衡来减缓病情进展。血管紧张素转换酶抑制剂(ACEI)能显著降低心力衰竭患者的死亡率和住院率,适用于所有程度的HF,包括左心室功能不全的患者。此外,血管紧张素受体-脑啡肽酶抑制剂(ARNI)如沙库巴曲/缬沙坦,通过抑制脑啡肽酶增加利尿、排钠作用,减少心脏重构,为HFrEF患者提供了新的治疗选择。然而,对于晚期CKD患者,ARNI的研究尚不充分。
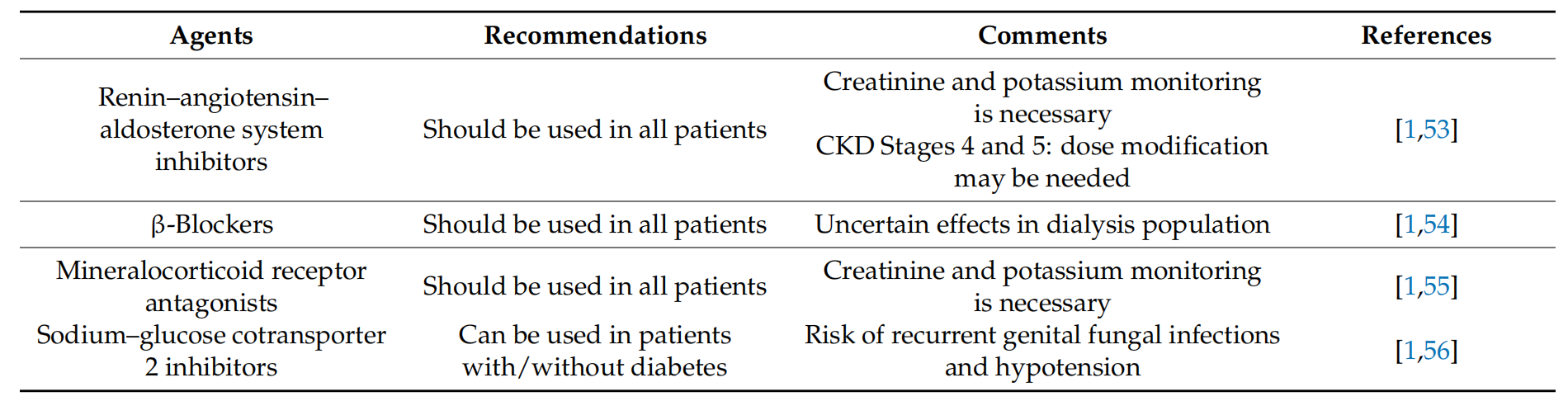
CKD患者中HFrEF的药物治疗
3.2β-受体阻滞剂
能够改善心脏的血流动力学状况。它们与ACEI具有同等重要的治疗地位。β-受体阻滞剂如美托洛尔和卡维地洛,已被证明能降低HFrEF患者的死亡率和心脏移植的需求,并改善症状评分。尽管如此,对于透析人群中β-受体阻滞剂的效果尚不确定,但在开始透析的第一年内,β-受体阻滞剂的使用已显示出降低心力衰竭死亡率的显著效果。
3.3盐皮质激素受体拮抗剂
盐皮质激素受体拮抗剂(MRA)通过阻断醛固酮受体来治疗心力衰竭,已被证明可减少心血管事件和死亡风险。螺内酯或依普利酮被推荐用于所有心力衰竭患者,以补充标准治疗。尽管可能引起高钾血症或GFR下降等副作用,但这些不良效应不常见,且通过密切监测和谨慎调整剂量可以得到有效管理。
3.4钠-葡萄糖共转运蛋白2抑制剂
钠-葡萄糖共转运蛋白2抑制剂(SGLT2抑制剂)是一类新型药物,它们通过抑制肾脏对葡萄糖的重吸收来降低血糖水平。这类药物不仅适用于糖尿病患者,也被推荐用于无论是否伴有糖尿病的心力衰竭患者。SGLT2抑制剂能够减少心血管死亡和全因死亡,降低住院率,并具有肾脏保护作用,减少蛋白尿和慢性肾脏疾病进展的风险。然而,它们可能会引起生殖器真菌感染和低血压等副作用。
3.5医疗设备
心脏再同步治疗(CRT)和植入式心脏去颤器(ICD)作为心力衰竭患者的非药物治疗方法,CRT是治疗HF的常见非药物疗法,而ICD是预防心源性猝死的标准治疗。尽管CRT/ICD在HF患者中广泛应用,但在HFmrEF患者中的适用性证据不足。研究表明,CRT与ICD联合使用可降低死亡率和HF住院率,但在透析患者中,ICD-CRT组合与更多的不良事件相关。
3.6肾脏替代治疗
肾脏替代治疗(KRT)是在患者eGFR低于20 mL/min per 1.73 m2时考虑的治疗选项。在决定实施KRT时,需综合考虑合并症、患者预期和生活质量。透析患者若伴有心力衰竭等合并症,其生存率较低。尽管如此,连续性腹膜透析(CAPD)在晚期心力衰竭患者中显示出积极影响,能够改善症状和左心室射血分数,且不良事件的发生率是可接受的。
3.7射血分数保留的心力衰竭
射血分数保留的心力衰竭(HFpEF)约占心力衰竭患者的一半,且患病率在上升。HFpEF患者中CKD更为常见,但目前尚无确切有效的治疗策略。治疗HFpEF主要侧重于症状管理和共病优化,利尿剂在治疗中起到关键作用,可减少心力衰竭恶化风险并提升运动能力。然而,对于降低死亡率和发病率,RAAS-I、MRA或SGLT2抑制剂尚无有力证据。
未来治疗策略
4.1 SGLT2抑制剂
最近的临床试验表明,SGLT2抑制剂,特别是达格列净(dapagliflozin),可在心力衰竭患者中减少死亡率和住院治疗,无论是否存在糖尿病。
4.2非奈利酮(Finerenone)
新型非甾体MRA非奈利酮对心血管和肾脏器官保护有益处,特别是在有白蛋白尿和2型糖尿病的患者中。
4.3卡那单抗(Canakinumab)
随机对照试验表明,卡那单抗治疗可能与心血管事件的减少有关,包括在CKD患者中的心肌梗死后患者。
结论
伴随疾病是HF患者的常见且不利指标。它们与更高的死亡率和增加的住院治疗密切相关。在这篇综述中,我们专注于CKD和HF共存的重要治疗策略。我们关注了2021年ESC指南中提到的主要药物类别,并考虑了ICD和CRT等设备的优势和劣势。此外,我们还触及了肾脏移植的主题。这些发现可能为未来的心力衰竭患者及其多病共治的管理提供新的见解,并确定潜在的治疗靶点。
参考文献
[1]Szlagor,M.;Dybiec,J.;Młynarska,E.;Rysz,J.;Franczyk,B.Chronic Kidney Disease as a Comorbidity in Heart Failure.Int.J.Mol.Sci.2023,24,2988.https://doi.org/10.3390/ijms24032988
原创文章:方舟健客版权所有,未经许可不得转载。