PCSK9i 可显著降低有 CAD 史的患者的斑块容积和脂质含量
 健客医生官方号
健客医生官方号研究出处:Eur Heart J Cardiovasc Imaging. 2021. DOI: 10.1093/ehjci/jeab034,PMID:33637979. 1
多项随机对照试验证实强化降脂治疗可降低心肌梗死、缺血性卒中和冠脉血运重建的发生率、减少死亡、显著改善ASCVD患者预后2,3。而对于急性冠脉综合征(ACS)的患者,即便接受了PCI,罪犯和非罪犯病变仍可能导致再次心血管事件的发生4。纠其原因,是ACS患者的冠状动脉中仍存在易损斑块。易损斑块一旦破裂,将极有可能导致再次血栓事件和冠脉事件。已有研究表明,薄纤维帽动脉粥样斑块(TCFA),是非罪犯病变和再发心血管事件关联性的独立预测因素4。此前早有学者指出,相比冠脉血管造影,冠状动脉内病理学特征更应该用于指导和管理ACS5。因此,冠心病患者的斑块管理成为了近年来的热点。近期的临床研究表明:使用他汀联合依洛尤单抗的强化降脂治疗方案能显著减少冠心病患者的斑块体积,然而使用PCSK9i后血清LDL-C水平的下降和动脉斑块中脂质成分变化间的联系目前尚不明确6。
本研究的目的:旨在确定PCSK9i对冠状动脉疾病史患者的冠状动脉斑块容积和脂质成分的影响。
这项前瞻性,开放标签,单中心研究在基线和随访血管造影时,使用近红外光谱- 血管内超声 (NIRS-IVUS) 分析非犯罪冠状动脉段。
纳入53例曾接受过冠状动脉造影(CAG)和NIRS-IVUS的CAD患者,提前接受至少四周的稳定LLT,且NIRS-IVUS的基线LDL-C水平≥80mg/dL。依2018年AHA/ACC指南界定的有无“极高风险CAD” 将受试者被分成两组:
● 试验组:“极高风险CAD”接受 PCSK9i 和他汀类治疗 (21 例, 40 段);即于基线NIRS-IVUS后立即接受最大耐受剂量的他汀治疗,并于其后使用PCSK9i治疗;
● 对照组:非“极高风险CAD”仅使用他汀类治疗 (32 例, 50 段)。
患者于12±3个月后进行CAG和NIRS-IVUS随访。
排除标准:
(1)慢性肾脏病(估算肾小球滤过率<40 mL/min / 1.73m2);
(2)于筛查、体检或实验室检查中发现任何合并症或临床上明显的异常,或研究者判断的任何可能影响患者安全完成研究的事件。
图1 研究流程图
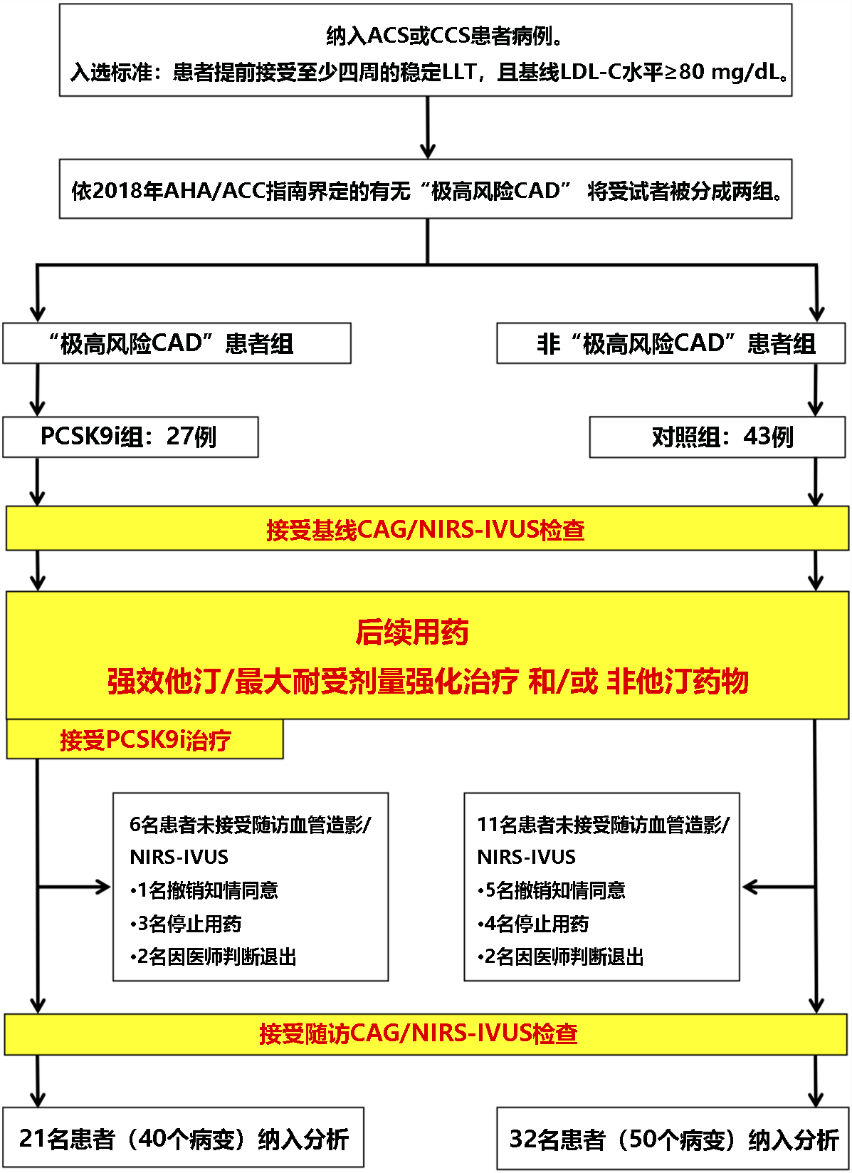
注:ACS :急性冠状动脉综合征; CCS :慢性冠状动脉综合征; CAD :冠状动脉疾病; CAG:冠状动脉血管造影; LLT:降脂治疗。
1. 基线特征分析
两组之间的基线特征无显著差异(见表1)。所有患者从基线到CAG随访的平均持续时间为314.1±88.4天,而PCSK9i组从基线CAG到PCSK9i治疗的平均持续时间为11.7±20.1天。基线成像后口服LLT的给药强度或百分比两组间相似。
表1基线特征和降脂治疗
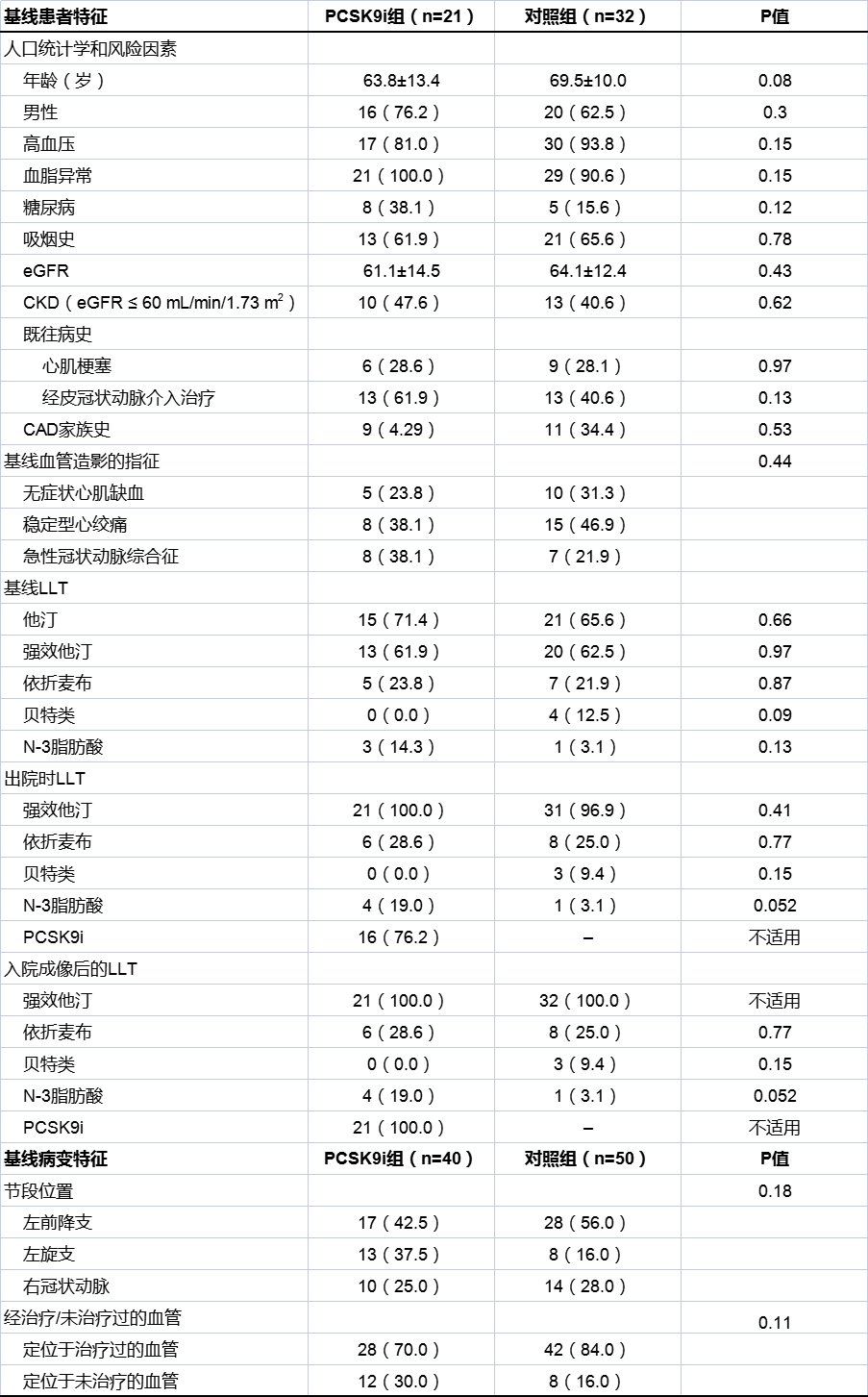
注:平均值±SD或n(%)。强效他汀指阿托伐他汀,匹伐他汀和瑞舒伐他汀。通过以下公式为日本患者计算eGFR。eGFR(男性)= 194x血清肌酐-1.094 x年龄-0.287,eGFR(女性)=(194 x血清肌酐-1.094 x年龄-0.287)x0.739。CKD:慢性肾脏疾病;eGFR:估算的肾小球滤过率;LLT:降脂治疗。
2. 结果分析
1. 相比对照组,PCSK9i 可非常显著地降低 LDL-C 绝对值和百分比降幅
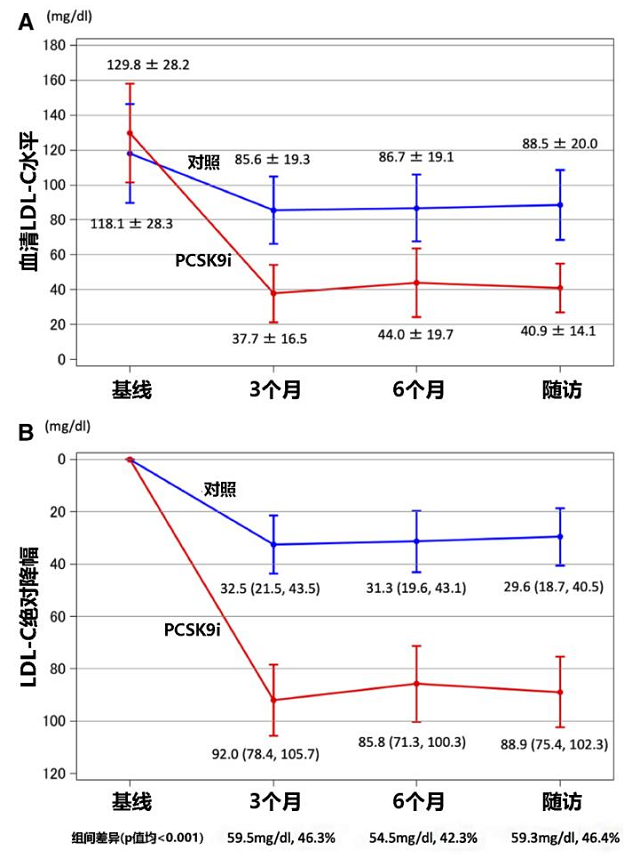
● 研究期间,PCSK9i组相比对照组可更强效、快速降低LDL-C水平(3个月时,92.0 vs. 32.5mg/dL;6个月时, 85.8 vs.31.3 mg/dL;随访时,88.9 vs. 29.6mg/dL; P值均 <0.001)(见图2A)。
● 随访期间, PCSK9i组LDL-C相比基线的绝对降幅和降低百分比显著高于对照组(组间差异:3个月时59.5 mg/dl和46.3%,6个月时54.5mg/dL和42.3%,CAG随访时59.3 mg/dL和46.4%,P值均<0.001)(见图2B)。
图2随访期间LDL-C水平变化
● 随访期间, PCSK9i相比对照组可更显著降低LDL-C及总胆固醇水平(见图2,表2)。
表2基线和随访时的生物标志物概况(均数±标准差)
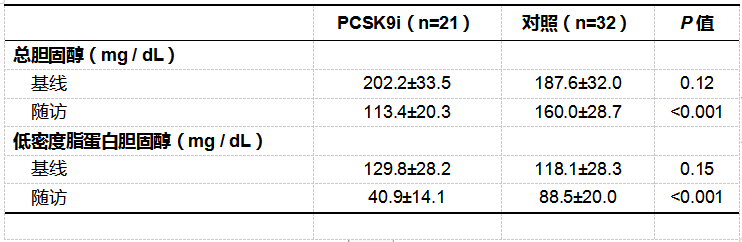
2.PCSK9i显著增加动脉粥样硬化管腔体积和降低最大脂质核心负担指数
● 从基线到随访期间,PCSK9i组显著增加管腔体积,显著降低总动脉粥样硬化体积(TAV)、动脉粥样硬化体积百分比(PAV)和每4mm节段最大脂质核心负荷指数(maxLCBI4mm)(P值均<0.001)(见图3A);而对照组他汀类治疗对斑块体积、TAV和PAV无影响,但能显著减少maxLCBI4mm(P = 0.026)(图3B)。
图3基线与随访期间斑块特征的组间绝对变化比较
EEM:外部弹性膜;TAV:总动脉粥样硬化体积;PAV:动脉粥样硬化体积百分比。
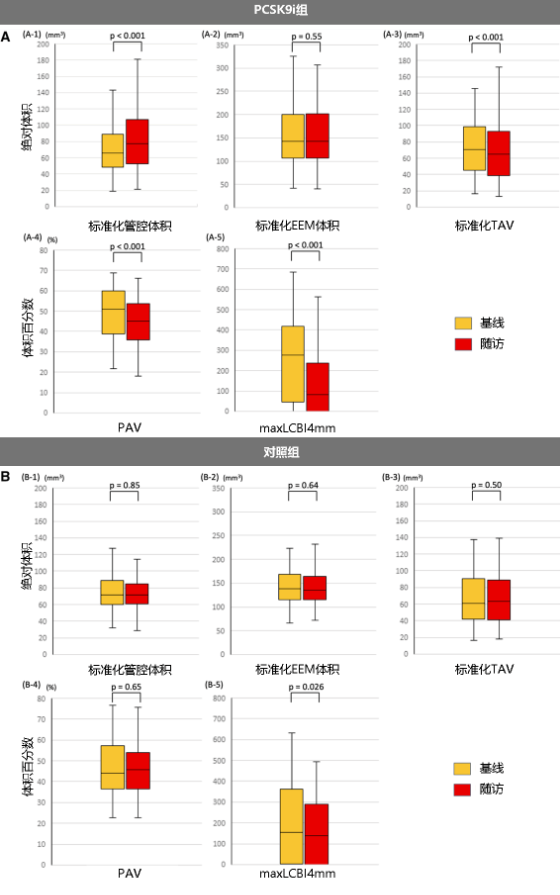
● 随访中发现PCSK9i组相比对照组可更显著减少标准化TAV和PAV(图4)。
图4斑块特征参数的绝对变化(PCSK9i vs. 对照组)
TAV:总动脉粥样硬化体积;PAV:动脉粥样硬化体积百分比。
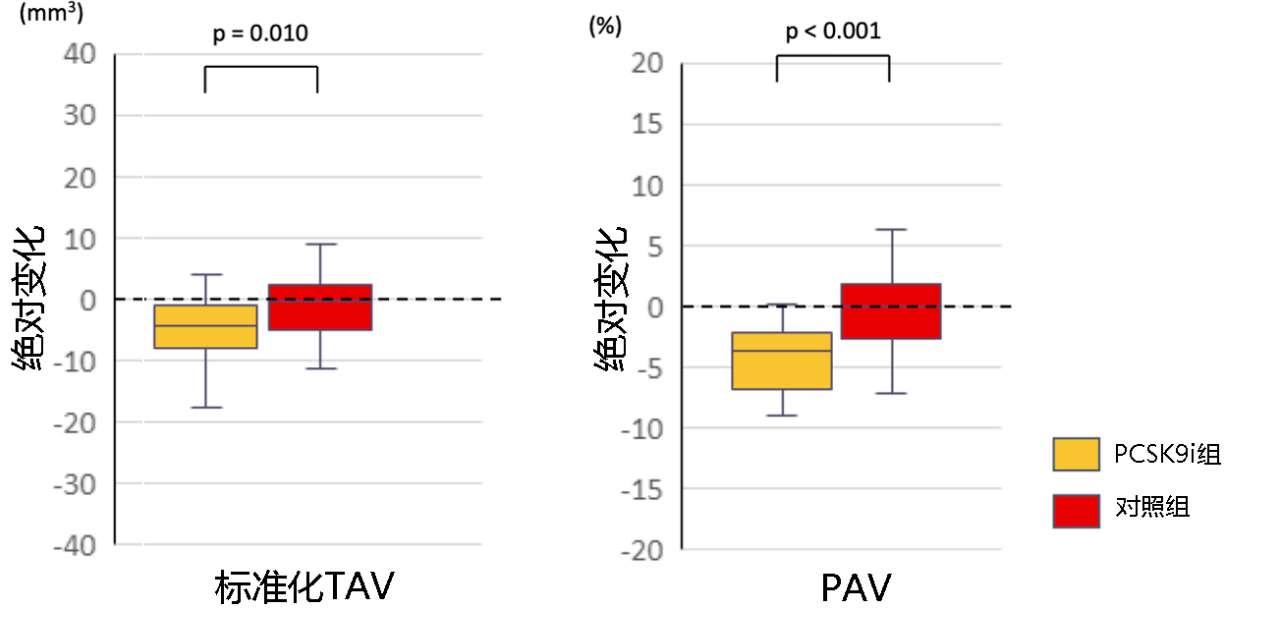
3.LDL-C百分比变化与NIRS-IVUS斑块特征参数呈线性相关
● LDL-C的百分比变化分别与maxLCBl4mm的变化(r=0.318;P=0.002)和PAV减少(r=0.386;P<0.001)呈线性正相关(见图5B和5D);另外,标准化TAV的百分比变化和LDL-C的百分比变化呈正相关(r=0.316;P=0.002)(见图5C);
● 相反,LDL-C的百分比变化与标准化管腔体积的百分比变化呈负相关(r=-0.317;P=0.002)(见图5A)。
图5 LDL-C的百分比变化与灰度及NIRS-IVUS产生的斑块参数之间的相关性
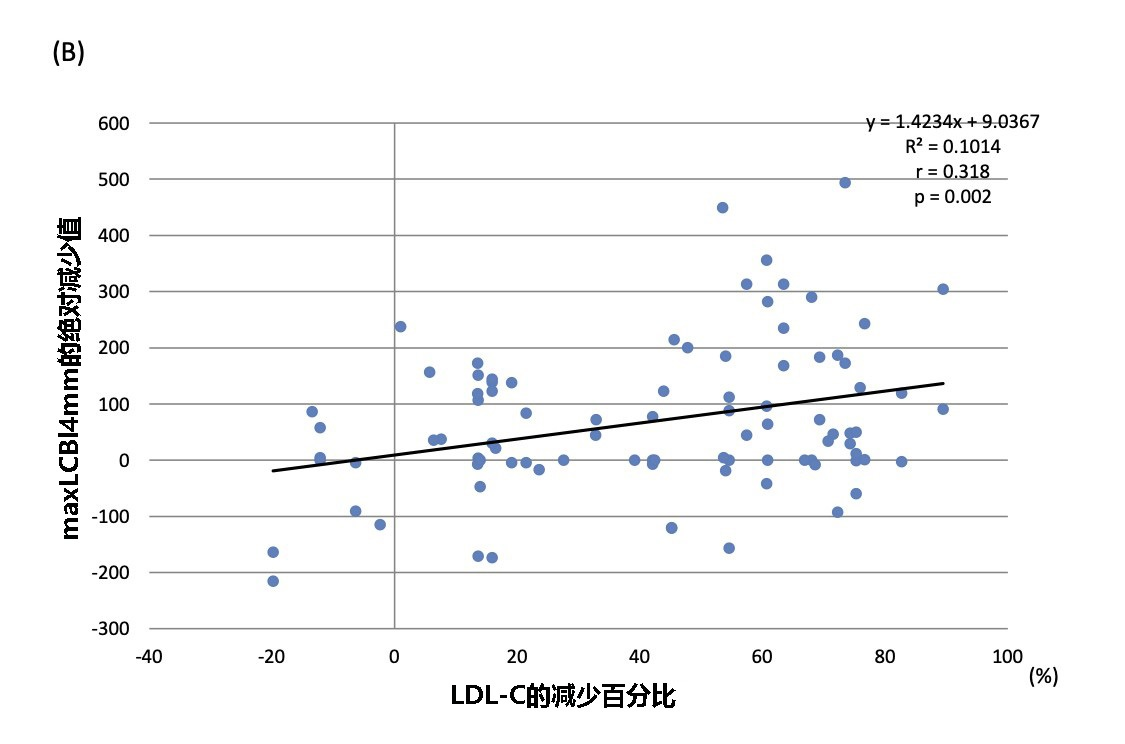
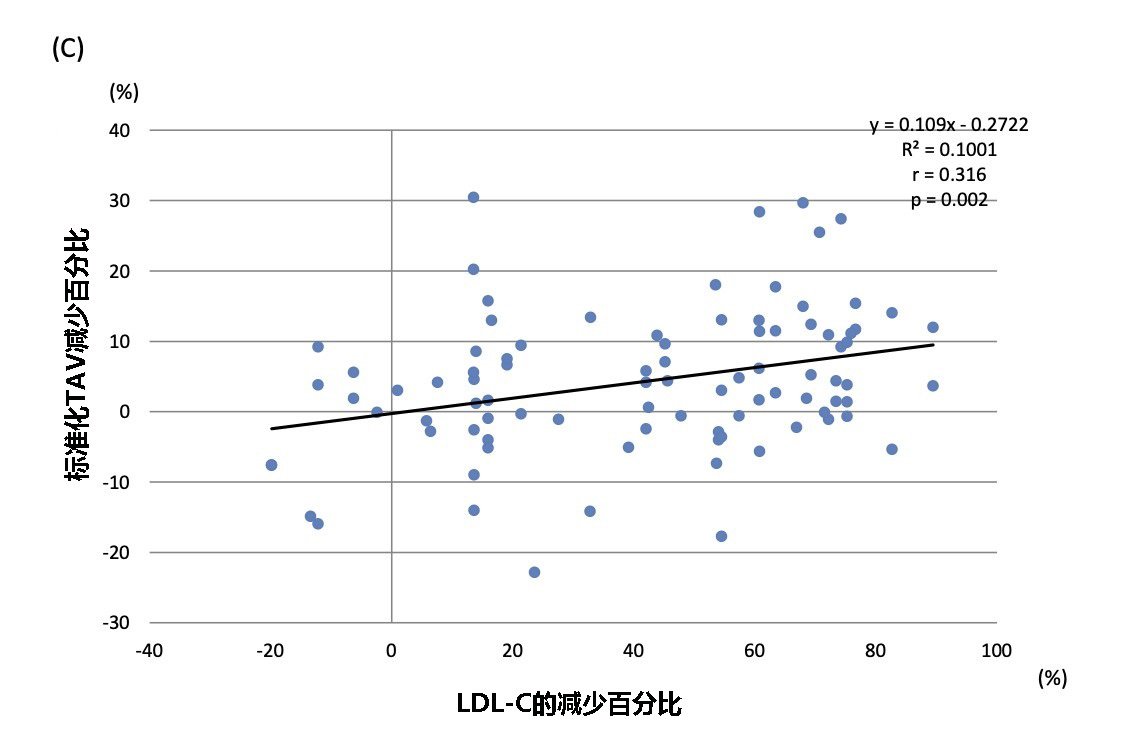
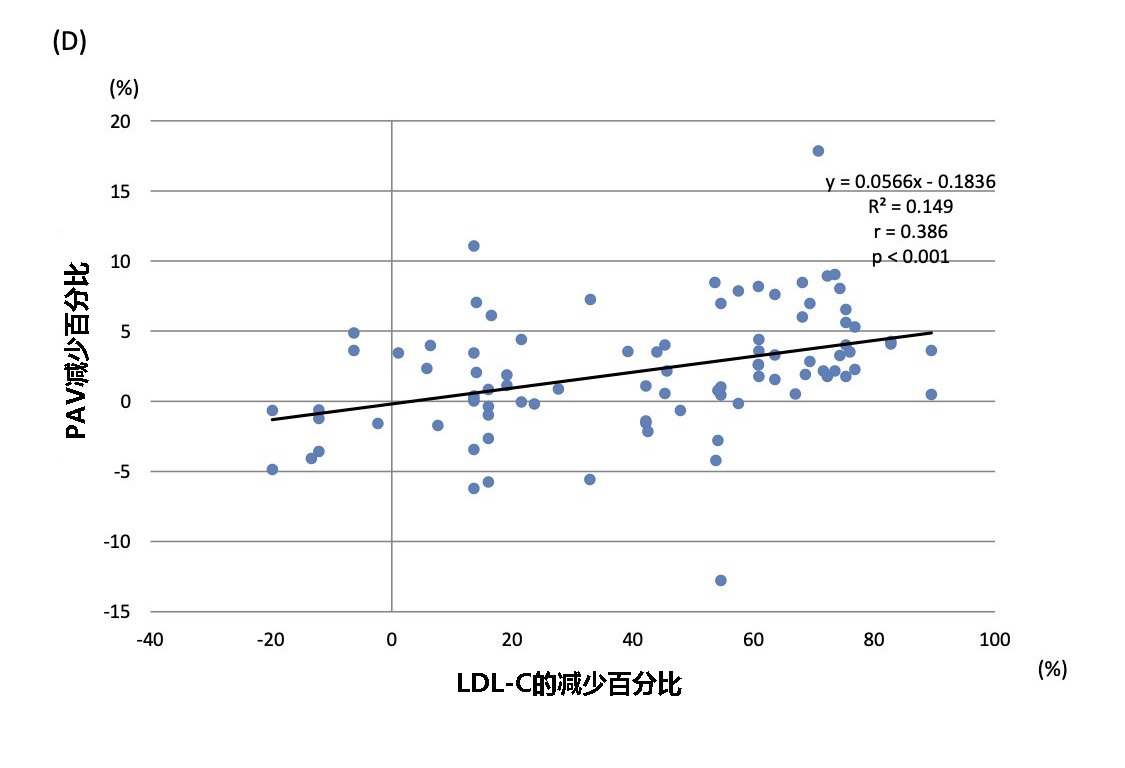
显示了LDL-C的百分比变化与(A)标准化管腔体积,(B)maxLCBI4mm的绝对减少值(C)标准化TAV减少的百分比,以及(D)PAV减少的百分比呈线性相关。
LDL-C:低密度脂蛋白胆固醇; EEM:外弹性膜; TAV:总动脉粥样硬化体积; PAV:动脉粥样硬化体积百分比
4.PCSK9i获益与非罪犯斑块的脂质分布相关(见图6)
● 在PCSK9i试验组maxLCBl4mm分数大于中位数(=232)的亚组中,患者斑块脂质分布变化显著。
● 无论maxLCBl4mm基线大小,PCSK9i组均可显著减少PAV。
图6按基线斑块脂质分布分组的灰度IVUS和NIRS参数的绝对和百分比变化
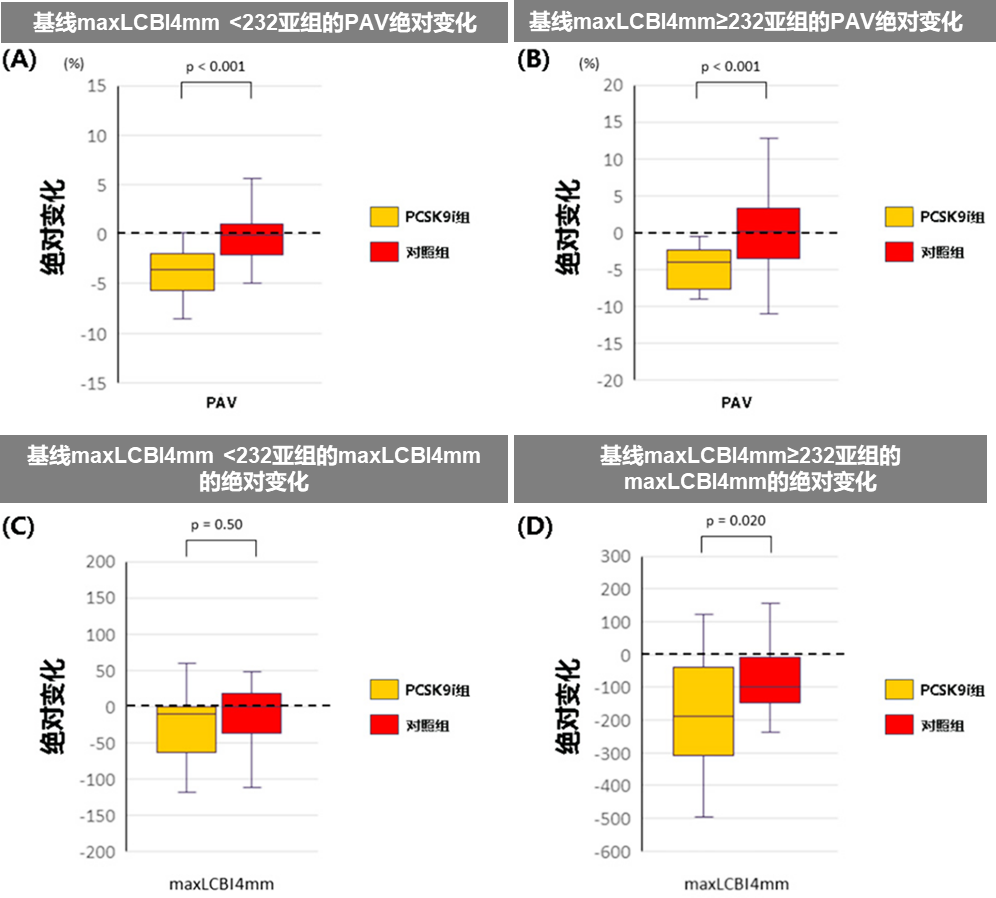
PAV:动脉粥样硬化体积百分比
一、强化降脂,LDL-C的降低有助于逆转斑块
在他汀时代已经有多项研究证实了LDL-C水平的降低和斑块体积减少的相关性。不仅如此,临床实践当中也越来越关注斑块的形态学特征以及运用新型的腔内影响学技术来识别高危斑块。PROSPECT研究证实:不稳定的高危TCFA和非罪犯病变的心血管事件增加之间存在相关性4。Backscatter-IVUS研究证实LDL-C的减低和斑块/脂质的减少存在相关性7。此外,另一项OCT研究也证实使用他汀降脂治疗能增加急性心肌梗死患者的斑块纤维帽厚度8。丰富的循证证据告诉我们,强化降脂治疗有助于斑块脂质的减少和斑块的稳定。
二、优化降脂策略,依洛尤单抗强效降脂,稳定和逆转斑块,改善临床结局
他汀的“6%效应“告诉我们,即便他汀剂量增加1倍,LDL-C降幅仅增加6%,这对于很多ASCVD患者来说,通过增加他汀剂量并不一定能使LDL-C达标,反而因为他汀剂量的增加某种程度上增加他汀不良反应发生的风险。尤其对于超高危的ASCVD患者,目前国内外指南共识推荐更严格的LDL-C靶标:要求LDL-C<1.4mmol/L且较基线降幅≥50%9,10。这使得临床医生需要为患者考虑他汀以外的更优化的降脂策略。多项大型研究证实,依洛尤单抗能在他汀基础上进一步降低LDL-C59%-75%11–13,且安全性耐受性良好13。GLAGOV研究证实:加用依洛尤单抗后,64.3%的患者实现冠脉斑块逆转,在基线LDL-C<70mg/dL的亚组中,依洛尤单抗使81.2%的患者冠脉斑块逆转6。日本OCT研究证实:ACS后早期使用依洛尤单抗治疗12周后冠脉斑块纤维帽增厚,脂质减少,斑块更稳定14。而本研究通过新型的NIRS-IVUS技术,评估和证实了PCSK9i稳定和促进斑块消退的作用。不仅如此,依洛尤单抗带来的临床获益还体现在对于心血管结局的改善上:FOURIER研究心梗(MI)亚组显示:依洛尤单抗可显著降低近期MI患者主要终点相对风险19%和关键次要终点相对风险25%;FOURIER研究既往接受过PCI亚组显示:依洛尤单抗显著降低既往接受过PCI的患者主要不良心血管事件(MACE)发生风险16%和主要冠脉事件发生风险18%。
结论:这项研究证明, PCSK9i 可显著降低CAD患者冠脉斑块的体积和脂质含量。 在 PCSK9i 治疗组观察到斑块体积和脂质分布的百分比降低与LDL-C 降低的百分比存在显著的正相关性。 这些结果表明, PCSK9i强效降脂,通过稳定非罪犯病变斑块,降低斑块体积,减少冠脉事件高风险患者的MACE发生风险,改善预后。
注:稳定和逆转斑块不在依洛尤单抗适应症范围之内。
参考文献
1. Ota H, Omori H, Kawasaki M, Hirakawa A, Matsuo H. Clinical impact of PCSK9inhibitor on stabilization and regression of lipid-rich coronary plaques: anear-infrared spectroscopy study. Eur Hear J - Cardiovasc Imaging. February2021. doi:10.1093/ehjci/jeab034
2. Prevention of Cardiovascular Events and Death with Pravastatin in Patientswith Coronary Heart Disease and a Broad Range of Initial Cholesterol Levels. NEngl J Med. 1998;339(19):1349-1357. doi:10.1056/nejm199811053391902
3. Nakamura H, Arakawa K, Itakura H, et al. Primary prevention ofcardiovascular disease with pravastatin in Japan (MEGA Study): a prospectiverandomised controlled trial. Lancet. 2006;368(9542):1155-1163.doi:10.1016/S0140-6736(06)69472-5
4. Stone GW, Maehara A, Lansky AJ, et al. A Prospective Natural-History Studyof Coronary Atherosclerosis. N Engl J Med. 2011;364(3):226-235.doi:10.1056/NEJMoa1002358
5. Nissen SE, Cleveland F. Pathobiology, Not Angiography, Should GuideManagement in Acute Coronary Syndrome/ Non-ST-Segment Elevation MyocardialInfarction The Non-Interventionist’s Perspective. 2003.doi:10.1016/S0735-1097(02)02775-4
6. Nicholls SJ, Puri R, Anderson T, et al. Effect of evolocumab onprogression of coronary disease in statin-treated patients: The GLAGOVrandomized clinical trial. JAMA - J Am Med Assoc. 2016;316(22):2373-2384.doi:10.1001/jama.2016.16951
7. Hattori K, Ozaki Y, Ismail TF, et al. Impact of statin therapy on plaquecharacteristics as assessed by serial OCT, grayscale and integratedbackscatter-IVUS. JACC Cardiovasc Imaging. 2012;5(2):169-177.doi:10.1016/j.jcmg.2011.11.012
8. Takarada S, Imanishi T, Kubo T, et al. Effect of statin therapy oncoronary fibrous-cap thickness in patients with acute coronary syndrome:Assessment by optical coherence tomography study. Atherosclerosis.2009;202(2):491-497. doi:10.1016/j.atherosclerosis.2008.05.014
9. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for themanagement of dyslipidaemias: Lipid modification to reduce cardiovascular risk.Eur Heart J. 2020;41(1):111-188. doi:10.1093/eurheartj/ehz455
10. 中华医学会心血管病学分会动脉粥样硬化与冠心病学组. 超高危动脉粥样硬化性心血管疾病患者血脂管理中国专家共识. 中华心血管病杂志.2020;48(4):280.
11. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and ClinicalOutcomes in Patients with Cardiovascular Disease. N Engl J Med.2017;376(18):1713-1722. doi:10.1056/nejmoa1615664
12. Robinson JG, Nedergaard BS, Rogers WJ, et al. Effect of evolocumab orezetimibe added to moderate- Or high-intensity statin therapy on LDL-C loweringin patients with hypercholesterolemia: The LAPLACE-2 randomized clinical trial.JAMA - J Am Med Assoc. 2014;311(18):1870-1882. doi:10.1001/jama.2014.4030
13. Sabatine MS, Giugliano RP, Wiviott SD, et al. Efficacy and Safety ofEvolocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med.2015;372(16):1500-1509. doi:10.1056/NEJMoa1500858
14. Yano H, Horinaka S, Ishimitsu T. Effect of evolocumab therapy on coronaryfibrous cap thickness assessed by optical coherence tomography in patients withacute coronary syndrome. J Cardiol. 2020;75(3):289-295.doi:10.1016/j.jjcc.2019.08.002